Какой металл легче воды
Килограммовую гирю можно изготовить и из железа, и из алюминия. Но так как алюминий примерно втрое легче железа, то при одинаковом весе гиря алюминиевая будет по объему втрое больше железной. Поставим на одну чашку весов железный килограмм, на другую – алюминиевый; весы, конечно, будут в равновесии. Теперь вообразите, что наши весы с гирями очутились под водою. Сохранится ли равновесие? Если нет, то которая чашка перетянет?
Чтобы ответить на этот вопрос, нужно вспомнить, что каждая вещь теряет в жидкости столько веса, сколько весит вытесняемая вещью жидкость.
В нашем случае чашки весов сами по себе теряют под водою одинаковый вес (они одной величины). Но гири теряют в весе не одинаково: крупная алюминиевая вытесняет больше воды, нежели мелкая железная; поэтому алюминиевая теряет в весе больше железной; останется же веса в алюминиевой гире меньше, чем в железной.
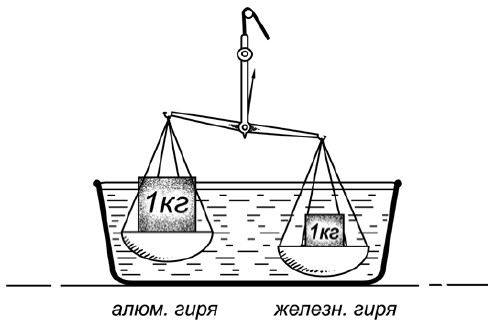
Рис. 40. Задача о весах под водою (ответ)
Значит, под водой весы никак не сохранят равновесия: чашка с железной гирей перетянет.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
РАБОТА С ТЯЖЕЛОЙ ВОДОЙ
РАБОТА С ТЯЖЕЛОЙ ВОДОЙ 8.55. В предыдущих главах уже упоминалось о преимуществах тяжелой воды в качестве замедлителя. Тяжелая вода лучше, чем графит, замедляет нейтроны и меньше, чем графит, их поглощает. Поэтому возможно построить аггрегат цепной реакции с тяжелой водой и
61 Звук под водой
61 Звук под водой Скорость распространения звука в воздухе мы уже знаем – примерно триста тридцать метров в секунду. А вот интересно, в воде звук распространяется быстрее или медленнее?Помните, я рассказывал про прохождение звука через стену? Так вот, чем более плотным
70 Шутка со стаканом и водой
70 Шутка со стаканом и водой Для опыта нам потребуются: обычный стакан с водой, квадратный кусок плотной бумаги. Это старинный опыт, не я его придумал, но, когда я спрашивал про него знакомых детей и их родителей, оказывается, его мало кто знает. Поэтому я решил тоже
Глава вторая На воде и под водой
Глава вторая На воде и под водой Почему киты живут в море? Задолго до того, как появился человеческий род, жили на суше животные таких больших размеров, каких нынешние сухопутные животные не достигают. Особенно крупны били ящеры, один из них – диплодок – имел 22 м в длину,
Человек под водой
2. Читатель узнает, что и пенсы могут служить науке. Что скрывалось за «грязью» в сосуде. Две тысячи метров под водой. Последствие одной аварии. Привидение, которое не возвращается.
2. Читатель узнает, что и пенсы могут служить науке. Что скрывалось за «грязью» в сосуде. Две тысячи метров под водой. Последствие одной аварии. Привидение, которое не возвращается. Одним из первых вступил на долгий и тернистый путь, ведущий к абсолютному нулю температуры,
ТОП-20 самых легких металлов

К легким причисляют металлы, плотность которых колеблется в диапазоне 5-7,5 граммов на кубический сантиметр. Еще один определяющий показатель — атомный вес. Легкие металлы задействованы в фармацевтической, энергетической, автомобильной, авиакосмической и других отраслях промышленности, в металлургии, строительной сфере и медицине. Они составляют 20 % от массы земной коры. ТОП-20 самых легких металлов во вселенной собраны в нашем перечне.
Литий
Это самый легкий металл из существующих в мире. Он выделяется серебристо-белым окрасом, предельно низким атомным весом и плотностью, которая в два раза меньше, нежели у воды. Пластичный литий имеет тридцать минералов, два изотопа природного происхождения. Температура плавления щелочного металла составляет +180,5 градуса Цельсия.
Литий — уникальный элемент, который всплывает на поверхности керосина. Он редко эксплуатируется в чистом виде, поскольку очень активен, легко вступает в реакции с окружающей средой. Это токсичный металл, поэтому в быту не применяется, но подходит для создания пиротехники, используется в роли окислителя, в пищевой промышленности, электронике, при производстве аккумуляторов, смартфонов, электромобилей. Литий в сорок раз меньше весит, чем иридий и осмий. Он был открыт в 1817 году шведским ученым — выделен из природного петалита.

Калий
Вторую строчку в ТОПе занимает калий. Это мягкий щелочной металл. В природе он обнаруживается исключительно в химических соединениях — в морской воде. Калий реактивно окисляется при попадании на воздух. Его открыли в 1807 году — выделили путем электролиза. К свойствам его относятся:
В жидком виде металл применяется для производства теплоносителей. Важнейший биогенный элемент используется при изготовлении удобрений, в гальванотехнике.

Натрий
Это высоко-реактивный металл с бело-серебристым окрасом (относится к категории щелочных). Мягкий натрий без труда режется ножом, блестит на срезе. В природе он содержится в морской воде. На воздухе он легко окисляется до оксида натрия. Этот легкий металл плавится при +97 градусах Цельсия, а кипит — при +882 градусах. Натрий впервые был добыт путем электролиза химиком Хэмфри Дэви в Великобритании.
Этот металл активно эксплуатируется в металлургии, при изготовлении энергоемких аккумуляторов, в создании ядерных реакторов и при анализе органических веществ, в газоразрядных лампах.

Рубидий
Один из самых легких щелочных металлов, с плотностью выше чем у воды. Рубидий имеет серый цвет с белым отливом. Его смогли выделить немецкие химики в 1861 году методом пламенной спектроскопии. Этот металл вступает в химическую реакцию с водой, самовоспламеняется на воздухе, плавится при +39,3 градусах Цельсия.
Рубидий — моноизотопный, радиоактивный элемент. Он занимает 23 ступень по уровню распространенности в земной коре, встречается чаще меди и цинка. Этот металл используется при изготовлении пиротехнической продукции, в ядерной медицине и промышленности. Его эксплуатация важна при производстве паровых турбин, топливных генераторов.

Кальций
Это щелочноземельный металл, легко взаимодействующий с углекислым газом и кислородом. Кальций имеет серую тусклую поверхность со светло-желтым оттенком. Получают его путем электролиза или алюминотермии. Природный калий состоит из трех изотопов. По степени распространенности элементов в земной коре он занимает пятое место. Металлический кальций плавится при +884 градусах Цельсия. Он активно применяется при выплавке стали из-за сходства по свойствам с кислородом. Кальций используется в металлургии, для выделения азота из чистого аргона, при производстве циркония и урана.

Магний
Этот металл с малой атомной массой был получен в 1808 году. Он характеризуется пластичностью, без труда поддается резке, обработке. Магний плавится при +650 градусах, не боится коррозии.
В составе минералов и солей металл обнаруживается в земной коре, морской воде. Залежи природного магния находятся в Таджикистане и Восточной Сибири. Он используется в автомобиле- и самолетостроении, при производстве пиротехники, поскольку обладает высокими горючими свойствами. Магний применяется и при создании вооружения. В порошкообразной форме он применяется в фотографическом мастерстве.

Бериллий
Сероватый цвет, высокая хрупкость и токсичность характеризуют еще один легкий металл. В чистом виде он был получен в 1828 году. Название металл получил от известного минерала — берилла. В природе он встречается в магме, горных породах. Бериллий добывают в Индии, Бурятии, Казахстане.
Этот металл применяется в виде добавок при легировании сплавов. Он почти не поглощает рентгеновское излучение, поэтому применяется при создании детекторов гамма-излучения. Используется бериллий в аэрокосмической промышленности, в акустике, задействован в ядерной энергетике.

Цезий
Один из самых мягких и легких металлов с температурой плавления всего +28,6 градуса Цельсия. При комнатной температуре он находится в полужидком состоянии. Он представляет собой вещество золотистого цвета, отлично отражает свет. Этот металл открыли в 1860 году в Германии, но в чистом виде его получил уже шведский химик и только через 22 года.
Цезий используется как катализатор в органическом и неорганическом синтезе, в инфракрасных аппаратах и очках, при изготовлении светящихся трубок. Он применяется в энергетике и медицинской сфере. Кстати, на основе цезия создают твердые электролиты для автомобильного топлива.

Стронций
Месторождения стронциевых руд разрабатываются в Тульской области и в Дагестане. Стронций эксплуатируется в металлургии, пищевой и радиоэлектронной промышленности.

Алюминий
Один из самых распространенных металлов, который был открыт в 1825 году. До запуска масштабного производства алюминий ценился выше золота. Он обладает незначительными парамагнитными свойствами, проводит электрический ток и тепло. Алюминий подвергается механическому воздействию, но не коррозийному. Сплавы на его основе могут похвастаться пластичностью. Этот металл занимает третье место по степени распространенности в земной коре, плавится при +660 градусах.
Алюминий находит применение в черной металлургии, при производстве пиротехники, посуды, столовых приборов, в авиационной промышленности.

Барий
Это щелочноземельный металл, который быстро окисляется на воздухе, реагирует с водой, воспламеняется даже при слабом нагревании. Он активно взаимодействует с разбавленными кислотами. К другим свойствам бария относятся:
Серебристо-белый металл применяется в ядерно-энергетической отрасли, пиротехнике, оптике. В чистом виде барий получили в 1774-ом.

Титан
Металл насыщенного серебристого окраса был открыт в конце восемнадцатого века немецким химиком — выделен из минерала рутила. Образец металлического титана получили лишь в 1825 году. Он характеризуется высокой удельной прочностью и устойчивостью к коррозии. По концентрации титановых руд Россия находится на второй позиции в мире после Китая. К свойствам металла относятся:
- пластичность;
- хорошая ударная вязкость;
- температура плавления, которая составляет +1670 градусов Цельсия.
Титан используется в авиа-, кораблестроении, при производстве трубопроводов, в химической, автомобильной промышленности, при создании вооружения.

Германий
Хрупкий металл стального цвета с четко выраженным блеском. Это твердосплавный элемент, который плавится при +938 градусах Цельсия, кипит при +2850 градусах, является полупроводником. Германий был выделен в 1886 году немецким химиком Клеменсом Винклером. Это аномальное вещество, плотность которого увеличивается при плавлении.
Главные сферы применения германия — волоконная и тепловизорная оптика, электроника, химическая промышленность (в качестве катализаторов).

Галлий
Это мягкий, хрупкий металл стального цвета с синеватым оттенком. Он выделен в 1875 году французским химиком. Галлий плавится при +29,7 градусах Цельсия. Это один из наиболее дорогих металлов, свыше 97 % которого уходит на производство полупроводников. Галлий активно используется в медицине — в онкологии, в качестве антисептика.

Теллур
Хрупкий белый металл с блеском, применяется при производстве свинцовых сплавов. На просвет он выглядит красно-коричневым. Редкое, слегка токсичное вещество было обнаружено в Трансильвании в конце восемнадцатого века. Но выделить его в чистом виде удалось только через 17 лет. При нагревании металл становится пластичным. Он плавится при +448,8 градусах Цельсия.
Теллур широко применяется при создании полупроводников, в процессе вулканизации каучука. Металл используют при изготовлении ламп, специальных марок халькогенидных стекол.

Ванадий
Это пластичный металл средней твердости сине-стального цвета. Ванадий — хороший полупроводник. Он обладает высокими показателями теплоизоляции, отличается:
- податливостью;
- прочностью (тверже большинства сплавов).
Это редкий тугоплавкий элемент, который был открыт в 1801 году мексиканским профессором минералогии. Но сам ученый назвал его хроматом свинца. В чистом виде из железной руды ванадий был получен только в 1830 году шведским химиком. Этот металл плавится при +1887 градусах Цельсия. Он применяется как легирующая добавка для сталей, для изготовления электроники, сувенирной продукции, в металлургии, автомобильной промышленности, при производстве буровых установок.

Цирконий
Этот металл обладает высокой коррозийной стойкостью. Он встречается в природе в виде четырех стабильных изотопов. Серо-белый блестящий переходный металл отличается химической стойкостью. Он плавится при +1852 градусах Цельсия. Температура плавления составляет 4377 градусов. Цирконий встречается в 140 минералах, но не в самородном виде.
Металл был открыт в 1789 году, а в чистом виде — получен по истечении 35 лет после этого. Цирконий широко используется в авиационной, космической промышленности и медицине.

Это металл, который становится пластичным при 150 градусах Цельсия, а при 210 градусах — может деформироваться. Температура плавления — низкая. Она составляет 418 градусов. Металл характеризуется:
- высокой электропроводностью;
- химической активностью — сплавляется с щелочами, подвергается воздействию серной кислоты.
Цинк имеет голубовато-серый окрас. Он тускнеет на воздухе и покрывается слоем оксида, имеет пять стабильных изотопов. Этот металл был получен в 1746 году в Германии путем прокалки смеси оксида с углем. Цинк применяется при производстве ювелирных украшений (сплавы добавляются в золото), в автомобилестроении, для защиты металлов от коррозии, при изготовлении аккумуляторов и батареек.

Тугоплавкий, твердый металл с характерным блеском, имеет голубовато-белый окрас. Он царапает стекло, в чистом виде характеризуется пластичностью, отлично поддается механической обработке. При наличии азотно-кислородных примесей становится хрупким. Температура плавления — 1856 градусов Цельсия. Хром — составляющий компонент стали, который повышает ее прочность, закаливаемость, жаростойкость. Он был открыт во Франции в 1797 году. Химик Воклен выделил тугоплавкий металл с примесью карбидов. Используется хром в легированных сталях, в качестве эстетических гальванических покрытий. Он относится к токсичным элементам.

Марганец
Этот серебристо-серый металл напоминает железо. Он обладает незначительными парамагнитными свойствами, медленно окисляется и тускнеет на воздухе. Это твердый и хрупкий металл, который был открыт в 1774 году. Марганец имеет температурные показатели плавления и кипения 1246 и 2061 градус Цельсия соответственно.
Марганец используется для раскисления стали при ее выплавке, в металлургии и химической промышленности. Металл является остродефицитным сырьем в России. Известно лишь несколько месторождений (в Кемеровской области, Красноярском крае).
ТОП-20 самых тяжелых металлов в мире

Из 104 известных химических элементов 82 составляют металлы. Они задействованы в промышленности, сельском хозяйстве, строительстве, хозяйственной деятельности человека. К категории тяжелых относят металлы с плотностью от 5 г/см3. Еще одна определяющая характеристика — атомный вес (свыше 50 г/моль).

Занимает лидирующую позицию в мире по плотности. Его открыли в 1803 году. Одновременно за осмий «сражались» два ученых. Но в итоге более детальное описание сделал химик Смитсон Теннант. Температура плавления/кипения осмия составляет 2466 0С/4428 0С.
Редкий металл почти не поддается механическому воздействию из-за высокого показателя плотности. Обработка осмия требует больших затрат. Вот его свойства:
- тугоплавкость;
- непластичность;
- не поддается ковке;
- хлористый запах.
Осмий причислен к группе платиновых металлов. При застывании он кристаллизуется и становится ярко-голубым. Металл выдерживает сильное трение, механические воздействия, поэтому часто добавляется при изготовлении деталей, подвижных узлов оборудования для промышленности. Цена редкого металла за грамм превышает 10 000 долларов.

Этот металл на 0,09 г/см3 уступает осмию по плотности и занимает второе место в рейтинге. Они были открыты одновременно, имеют идентичные температуры плавления и кипения. Иридий тоже относится к редким металлам. Он не взаимодействует с водой, кислотами, воздухом. Иридий имеет белый цвет с серебристым отливом, зеркальной поверхностью. За год добывают не больше десяти тонн этого металла.
Иридий эксплуатируется в машиностроении, геологии, палеонтологии. Его выбирают для получения электричества, при изготовлении протезов (нервная электростимуляция). Иридий служит индикатором выявления слоев горных пород, для покрытия поверхностей по сложной технологии.

В рейтинге по «тяжести» она на третьей позиции. Платина — драгоценный, редкий элемент. Даже в самородной форме она включает железо, иридий и осмий, реже медные вкрапления. Платина — металл инертный, не вступающий в реакцию с агрессивными химикатами. Она имеет температуру плавления/кипения 1768 0С /3825 0С соответственно.
Платину используют в химической промышленности, ювелирном деле, автомобилестроении, при разработке и выпуске космолетов. Запасы этого драгоценного металла сосредоточены в пяти странах мира, включая Россию, Америку, Китай.

Это один из редчайших элементов на планете. О нем узнали в 1925 году благодаря немецким химикам Вальтеру и Иде Нодаккам. Серебристо-белый металл назвали в честь знаменитой реки Рейн в Германии. Рений имеет ряд особенностей:
- температура плавления — 3186 градусов Цельсия;
- сохранение прочностных характеристик при частом остывании и нагревании;
- температура кипения — 5596 градусов;
- ковкость;
- серебристо-белый цвет.
Эксплуатируется этот металл в авиационном и дорожном строительстве, подходит для изготовления деталей ракетных установок.

Этот радиоактивный элемент был получен при проведении ядерных реакций экспериментальным путем. Его открыли Макмиллан Э., Абельсон Ф. Название связано с восьмой по величине планетой Солнечной системы.
Нептуний плавится при 640 градусах Цельсия, а закипает при 3235 градусах. Это первый трансурановый элемент, который характеризуется хорошей ковкостью, быстро окисляется, но в реакцию с воздухом почти не вступает. При распаде этот металл опасен для человеческого организма, до 80 % частиц поражает костные ткани. Главная сфера применения — получение плутония.

Высокий уровень радиоактивности — главная отличительная особенность металла. В естественных условиях его почти не добывают. Основная доля получения плутония приходится на многоступенчатое урановое преобразование. Он имеет огромный военный потенциал, используется при создании ядерного оружия. Плутоний служит и энергетическим источником для космических кораблей. К характеристикам относятся:
- температура кипения — 3235 градусов;
- плохая токо- и теплопроводность;
- температура плавления — 640 градусов.
Из-за радиоактивности плутоний всегда кажется теплым. Он стал первым химическим элементом искусственного происхождения, производство которого достигло промышленных масштабов.

Это один из самых пластичных металлов. Золото отлично проводит электрический ток и имеет высокую плотность. Если бы не высокая стоимость металла, его бы активно использовали в процессе производства микросхем. Но золото занимает ведущие позиции в ювелирном деле. Вот его ключевые характеристики:
- температура плавления-кипения — 1064-2856 градусов Цельсия;
- мягкость, тягучесть;
- высокая теплопроводность;
- не взаимодействует с кислородом;
- устойчивость к химическим воздействиям.
Самые крупные запасы драгоценного металла зафиксированы на американском континенте. Золото применяется в стоматологии, гомеопатии, банковском деле, разных сферах промышленности. Это гарант валютной стабильности

Блестящий металл светло-серого цвета является самым тугоплавким на планете. Вольфрам — «лидер» и по максимально высокой температуре кипения на земле. Она достигает 3745 градусов. Плавится металл при 3422 градусах Цельсия. Вольфрам хорошо проводит тепло и электрическую энергию, не боится воздействия кислоты, легко поддается ковке. Используют его при производстве авиационных моторов, вакуумных систем. Именно вольфрам служит основой для выработки жаропрочных сплавов, применяется для создания нитей накаливания.

В естественных условиях этот радиоактивный элемент проходит многоступенчатый процесс преобразования в свинец. Все четырнадцать этапов его трансформации могут длиться миллионы лет. Уран обладает следующими свойствами:
- высокая пластичность (почти как у стали);
- быстрое окисление;
- самовоспламенение при 150 градусах Цельсия;
- самая большая на планете атомная масса;
- температура плавления/кипения — 1132 0С /3745 0С;
- ковкость;
- серебристо-белый или коричневатый окрас.
Уран активно используют при производстве ядерного оружия, реакторов, силовых установок. Ядерная промышленность — основная сфера эксплуатации этого вещества. Сейчас уран добывают преимущественно из морской воды.

Редкий белый металл с синеватым оттенком, который обнаружен в начале девятнадцатого века. Но до середины 19 столетия его отождествляли с ниобием. Тантал — один из самых тугоплавких металлов. Температура плавления — 3017 градусов Цельсия, кипения — 5458 градусов. Тантал легко обрабатывается, почти не поддается разрушению, коррозии. Он вступает в контакт с воздухом только при температуре +280 градусов. К другим свойствам относятся:
- устойчивость к агрессивным средам;
- пластичность;
- парамагнетизм.
В атомной промышленности, медицине, военной отрасли — тантал используется повсеместно.

металл с серебристым отливом, при комнатной температуре находится в жидком состоянии, имеет ядовитые пары. Это один из древнейших металлов, который находили в самородном виде. Ртуть получали и путем обжига киновари. Ее выделение в чистом виде было описано химиком Брандтом Д в 1734 году. Твердую ртуть впервые открыли Браун и Ломоносов. Ученые смогли заморозить ее и выделить следующие свойства:
- электропроводность;
- ковкость;
- высокая токсичность;
- температура плавления/кипения — 234К/629К.
Ртуть присутствует во многих сульфидных минералах — особенно в рудах и антимонитах. Ее используют при производстве барометров, термометров, манометров, вакуумных насосов, ламп.

Редкий металл с белым блеском относится к элементам платиновой группы. Родий эффективно противостоит коррозии. Он присутствует в природе в виде сплава или свободного металла, содержится в никелевых и платиновых рудах. Родий был открыт Уильямом Волластоном в 1803 году. Металл не окисляется при нагревании, не подвергается кислотному воздействию. Температура плавления/кипения — 1964/3695 градусов Цельсия.
Свыше 80 % мировых запасов родия уходит на производство катализаторов. Применяется он и при создании ядерных реакторов, в ювелирном деле. Из родия в сплавах с палладием и платиной делают покрытия, которым не страшна коррозия.

Этот металл из платиновой группы встречается как второстепенный компонент руд. Твердый элемент белого цвета легко подвергается воздействию окислителей, растворяется в щелочах. Но рутений не способны разрушить кислоты — даже «царская водка». Температура плавления — 2334 градуса, а кипения — 4150 градусов Цельсия.
Рутений сплавляют с металлами, не относящимися к платиновой группе, для улучшения их свойств. Его используют в микроэлектронике, в турбинных реактивных силовых агрегатах, в качестве катализаторов.

Редчайший минерал серебристого цвета не тускнеет на воздухе. Он был обнаружен в самородках в 1803 году. Ковкий, тягучий металл растворяется в азотной, серной кислотах, прокатывается до состояния проволоки. Парамагнитный элемент не отличается стойкостью к действию окислителей.
Температура плавления — 1554 градуса, кипения — 2940 градусов Цельсия. В земельных недрах доля достигает 6 %. Основные залежи — на Кольском полуострове, на Урале. Палладий используется как катализатор, востребован в аэрокосмической промышленности. Он входит в состав конденсаторов, задействован в медицине для изготовления протезов, кардиостимуляторов.

Это тяжелый металл с голубоватым оттенком, который быстро окисляется от соприкосновения с воздухом из-за высокой химической активности. Таллий открыли в 1861 году в Великобритании спектральным методом. Он тускнеет на воздухе, присутствует в земной коре и морской воде — до 10 %. Таллий плавится уже при 304, а кипит — при 1473 градусах.
Металл применяется в медицинской сфере для кардиологических исследований, в приборах ночного видения и осветительном оборудовании.

Слаборадиоактивный металл серебристого цвета, который при длительном пребывании на воздух становится черным. Торий был выделен ученым Берцелиусом Й. Из торита в 1828 году и назван именем бога грома скандинавской мифологии. Он содержится в монаците, торианите, эвксените и других минералах. Основные месторождения сосредоточены на Шри-Ланке, в Индии, Австралии, США. Выделим свойства металла:
- плохо растворяется в кислотах, не взаимодействует с едкими щелочами;
- ковкость;
- медленное корродирование в холодной воде;
- легко воспламеняется;
- температура плавления/кипения — 1750/4788 градусов.
Торий применяется в медицине (рентгеноконтрастные препараты), в металлургической промышленности и атомной энергетике.

Легкоплавкий тяжелый серебристый металл с синеватым отливом. Это ковкий, токсичный элемент. Он легко обрабатывается, пластичен. Свинец получают из руд, в которых содержится галенит.
Металл обладает низкой теплопроводностью, подвергается механическим повреждениям, на воздухе покрывается тонкой оксидной пленкой. Он плавится при 327 градусах, а кипит — при 1749 градусах Цельсия. Свинец активно используется в медицине, геологии, для производства взрывчатки, аккумуляторных батарей.

Это пластичный серебристо-белый благородный металл, который обладает высокой ковкостью. Он плавится при 962 градусах. Температура кипения — 2162 градуса Цельсия. Серебро содержится в земной коре (до 70 г/т), глинистых сланцах, входит в сульфиды меди.
Этот драгоценный металл широко эксплуатируется в медицинской отрасли, при производстве диагностического оборудования, в фотографии, при изготовлении катодов, в качестве дезинфектора.

Занимает предпоследнее место в рейтинге самых тяжелых металлов в мире. Тулий относится к группе лантаноидов. Это серебристый металл с белым отливом, который легко обрабатывается. Соли тулия окрашены в зеленый цвет. Элемент открыл химик из Швеции Клеве Т. В в 1879 году. В коре земли тулия не больше 2,7 %. Температура плавления/кипения — 1818К/2220К.
Тулий используют для производства магнитных носителей информации, лазерных материалов, в атомной энергетике.

Высокоактивный редкоземельный металл серебристого цвета был открыт в 1847 году русским горным инженером Самарским В.Е. и назван его именем. Самарий медленно окисляется на воздухе, растворяется в кислотах, вступает в реакцию с азотом, кремнием, углеродом и бором. Температура плавления — 1350К, кипения — 2064К.
Самарий применяется при изготовлении сверхмощных магнитов, тензочувствительных датчиков, в ядерной энергетике, при конструировании магнитных холодильников, в стекольном деле, в качестве огнеупорных материалов.
Таблица самых тяжелых металлов (список по убыванию плотности)
ТОП-20 самых прочных и крепких металлов

Прочность металла — это его устойчивость к нагрузкам, способность внутренней структуры противостоять внешнему воздействию. Для выявления самого крепкого металла за основу можно взять предел прочности или текучести в МПа. Эти величины показывают, какое усилие нужно приложить для нарушения молекулярных связей в материалах. Чем выше предел прочности, тем крепче металл. Наиболее устойчивые к воздействиям материалы активно применяются в машиностроительной и оборонной промышленности, в самолето-, ракетостроении, в строительстве и при сооружении металлоконструкций, спецтехники для индустриальных комплексов. В нашем ТОП-20 собраны самые крепкие металлы в мире с учетом показателей предела прочности.
Иридий

В России его ставят на одну планку с драгоценными. Иридий входит в платиновую группу. Этот металл открыл в 1803 году британец Теннант. Свое название («радуга» в пер. с греческого) иридий получил из-за красочных солей разных оттенков, которые выпадают в осадок при вступлении в реакции с ним. К особенностям металла относятся:
- высокая твердость — иридий является одним из немногих металлов, которые сложно обрабатывать;
- плавление материала при + 2466, закипание при +4428 градусах;
- сохранение инертности — при подогреве.
Иридий применяется для авиа-, космической промышленности. Без этого материала не обходится изготовление высокопрочных автомобильных деталей.
Рений
Название этого крепкого металла имеет «речное» происхождение. Свое наименование рений получил в честь немецкой реки Рейн. Официально металл был открыт в 1928 году, но только через два года его производство приобрело промышленные масштабы. Рений извлекается из молибденовых руд и обладает следующими свойствами:
- тугоплавкость — расплавить металл можно только при +3200 градусах Цельсия;
- высокая пластичность;
- кипит только при +5600 градусах;
- выдерживает много циклов охлаждения и последующего нагрева без потери прочности;
- сравнительно высокая плотность — 21 грамм на куб. сантиметр.
Рений используют при сооружении ракет, подготовке высокопрочных сплавов, в электронике и электротехническом оборудовании.
Вольфрам
История этого прочного металла началась в 50-х годах 18 века. Но только в 1780 году он был официально открыт химиками Элюар из Испании. Братья провели ряд исследований элемента и выявили его важнейшие свойства. Крупнейшие залежи металла в виде окисленных соединений базируются в Канаде и США, на территории Казахстана. Из-за высокой прочности этот материал поддается обработке только порошковым методом. Среди свойств выделяются:
- термостойкость — плавиться вольфрам начинает при температуре от +2450 градусов;
- парамагнетизм;
- отличная звукопроводность — 4 300 метров за секунду.
Тугоплавкий металл используют в лампах накаливания, вакуумных системах, в оружейной промышленности. Он незаменим везде, где нужно выдерживать экстремальные температуры.
Серо-белый цирконий обладает повышенной устойчивостью к воздействию кислот, кроме горячей серной, не боится коррозии. Первооткрывателем стал Клапрот в 1789 году. Но лишь через 35 лет после этого металл обнаружили в аморфной среде. Кипит цирконий при +4377 градусах, а плавится — при +1855.
Этот металл встречается в земной коре в виде пяти изотопов — одного радиоактивного и четырех стабильных. Высокая химическая стойкость позволяет эксплуатировать цирконий для изготовления качественной посуды с отличными гигиеническими показателями. Применяется он при производстве хирургических инструментов, протезов.
Молибден

Первооткрывателем молибдена стал Карл Шееле в 1778 году. Но в металлической форме его получили только через три года. В чистом виде молибден был выделен в 1817 году путем восстановления оксида водородом. Крупнейшие месторождения находятся в США, Мексике, Норвегии и Канаде.
Молибден парамагнитен, имеет низкий коэффициент теплового расширения, плавится при 2 620 градусах Цельсия. В природе встречается в виде семи изотопов. Этот металл нужен для легирования сталей, при создании жаростойких сплавов, используется в вакуумных печах в форме нагревательных элементов. Чистый молибден выбирают для лазерного оборудования.
Хром
Этот металл с голубоватым оттенком был получен в 1797 году в форме карбида. Первооткрывателем стал французский химик Воклен. Один из самых твердых элементов сложно назвать редким — его содержание в земной коре превышает 0,03 грамма на тонну от общей массы. Но в чистом виде хром не встречается. Среди свойств выделяются:
- парамагнетизм — проявляется при температуре выше +37 градусов Цельсия, антиферромагнитные свойства — при температуре ниже указанного значения;
- отсутствие реакции с кислотами — элемент не подвергается их воздействию;
- температура плавления — 1857 градусов.
Хром добавляется в легированные стали для увеличения их прочности в два-три раза. Он используется и при окрашивании, нанесении покрытий, производстве тугоплавких материалов, как катализатор в процессе обработки углеводорода.
Этот элемент стал открытием 1791 года — одновременно в Германии и во Франции. Но его выделили в чистом виде только через тринадцать лет в Швеции. В 1940 году после получения патента на восстановление титана из тетрахлорида началось производство металла в промышленных масштабах. Залежами этого металла богаты страны Россия, Канада.
Титан — металл пластичный, но крепкий. Степень его прочности зависит от обработки. Плавится материал при +1700 градусах Цельсия. Используют титан для производства бронированных жилетов и обшивки подводных лодок, при изготовлении трубопроводов и реакторов, медицинских протезов и имплантов. Он добавляется и в легированные стали для упрочнения.
Уран

Это элемент, который слабо вступает в реакции с другими веществами. В чистом виде его удалось выделить лишь в 1840 году. Радиоактивный металл является одним из самых прочных на планете. К его свойствам относятся:
- парамагнетизм;
- температура плавления +1100 градусов;
- большой удельный вес — 18,7 граммов на куб. см.
Уран имеет глянцевую поверхность с бело-серебристым оттенком. Она активно применяется в ядерной энергетике (при производстве топлива), для медицинского синтеза. Используют уран и при подготовке оружия в оборонной промышленности.
Никель

Это отличный катализатор, который обладает высокой прочностью и при повышенных температурных показателях. Никель — пластичный и ковкий ферромагнетик. Он устойчив к коррозии, окислению на воздухе, твердый и вязкий, хорошо полируется. Плавится металл при +1452 градусах Цельсия.
Никель — элемент с серебристо-белым окрасом, который был открыт в 1751 году шведским минерологом Кронстедтом. Из руды ученый выделил зеленый оксид, который в результате был восстановлен до никеля. Сейчас металл широко применяется в промышленности, на его основе делают суперсплавы с высокими эксплуатационными свойствами. Никель используется в монетном деле, при производстве аккумуляторных батарей, медицине. Никелирование защищает поверхности других металлов от коррозии.
Ниобий

Тугоплавкий и устойчивый к ржавлению материал относится к группе металлов. Он имеет серо-серебристый окрас, плавится при +2467 градусах Цельсия. К другим свойствам ниобия относятся:
- плотность — 8,57 граммов на кубический сантиметр;
- температура кипения — 4742 градуса.
В природе встречается единственный изотоп ниобия. Этот элемент открыли в Британии в начале девятнадцатого века. Он получил название колумбита. Только в 1952 году ниобий официально получил нынешнее обозначение. Месторождения материала находятся в Японии, на Кольском полуострове и в США. Применяется ниобий для изготовления деталей авиационной техники, легирования цветмета, в электронике и вычислительной технике.
Тантал
Металл сочетает серебристый и белый окрас, имеет плотную оксидную пленку. Тантал в чистом виде был получен в 1844 году немцем Розе. Но открыли его еще за сорок лет до этого. Содержание тантала в земной коре — до 0,000002 грамма на тонну от общей массы. Этим обусловлена его высокая цена — больше 250 долларов за грамм. Тантал плавится при температуре свыше +3000 градусов Цельсия, пластичен как золото, но очень крепок, имеет высокую плотность и не боится ржавчины. Он применяется в лабораторной посуде, хирургических инструментах, при создании жаростойких сплавов. Используется тантал и в системах ядерной энергетики, в автомобильной промышленности, электронике.
Железо

Это один из самых распространенных металлов (свыше 90 % в земном ядре), который сам по себе не отличается большой прочностью. Но в комбинации с углеродом и другими компонентами железо образует очень крепкие соединения — к примеру, сталь. К свойствам металла причисляют:
- способность намагничиваться;
- температуру плавления +1538 градусов Цельсия, закипания — более +2850 градусов;
- полиморфизм (четыре кристаллические модификации).
Среди сфер применения железа наиболее распространены машиностроение, сооружение крепежных элементов, производство стройматериалов и металлоконструкций.
Кобальт

Твердый, блестящий, тягучий металл визуально напоминает железо. Кобальт плавится при +1768 градусах Цельсия. Этот металл был открыт в 1735 году, но окончательно его позиционировали в качестве самостоятельного элемента только через 46 лет. Французский химик Макер определил металлургический метод получения кобальта. Кстати, его название происходит от слова «коболд», что означает гном или домовой. При обжиге некоторых кобальтовых минералов выделяются ядовитые окислы мышьяка.
Доля кобальта в земной коре составляет 4-10 % от общей массы. Этот металл используется в атомной промышленности, растениеводстве, при получении магнитов и сплавов повышенной прочности.
Медь

Медь — распространенный, прочный материал, хороший проводник электричества и тепла, компонент металлических сплавов, используемых в ювелирной промышленности. Плавится она при +1083 градусах Цельсия, а закипает — при +2562 градусах. Ковкая пластичная чистая медь имеет розовато-оранжевый окрас. Она подлежит вторичной переработке без потери качества.
Медь находится в тройке лидеров по объему мирового потребления и производства. Она применяется в химической промышленности, при производстве автомобилей и электроприборов, цифровой и бытовой техники, в тензометрических датчиках и монетном деле.
Осмий

Он стал известен в 1803 году благодаря британскому химику Теннанту. Осмий выделили в форме осадка после растворения платины в смеси азотной и соляной кислот. Осмий — металл голубовато-серого цвета, имеющий высокую удельную массу и прочность. Он сохраняет блеск и под воздействием экстремальных температур, Добывают металл в Сибири и на Урале, в США и Колумбии. Тугоплавкий осмий содержится в платиновых минералах и растворах с иридием. В земной коре — 0,007 грамма металла на тонну.
Осмий плавится при +3033 градусах. Это самый плотный элемент на планете (22,6 г/см3). Он почти не применяется в чистом виде — исключительно с легирующими добавками. Металл из платиновой группы широко распространен в ядерной промышленности.
Это легкий металл, имеющий небольшую плотность, малый вес. Он подвергается разным методам обработки — от ковки и прокатки до сварки и штамповки. Открыли магний в 1809 году в Великобритании. Химик Гемфри Дэви получил металл путем электролиза смеси из оксида ртути и магнезии. Температура кипения магния — 1090 градусов, а плавится он при +650 градусах Цельсия. Металл отлично прессуется, прокатывается, поддается резке при высокой чистоте.
Магний используется в качестве огнеупорного материала, при создании ракет в военном деле, в медицине, фотографии, при изготовлении аккумуляторных батарей. Его запасы сосредоточены в Норвегии, США и Китае.
Относительно распространенный металл был открыт французским химиком Вокленом в 1798 году. Его содержание в земной коре достигает четырех граммов на тонну в общей массе. Ключевые месторождения сосредоточены вблизи вулканов — в США, Китае и Казахстане. Бериллий обладает:
- высокой упругостью;
- максимальной звукопроводимостью — 12,5 метра в секунду;
- высокой токсичностью.
Металл обладает канцерогенным действием. Но его успешно эксплуатируют в акустике, ядерной энергетике, при изготовлении лабораторных тиглей, в аэрокосмической технике, при создании вакуумных труб и огнеупорных материалов.
Это один из ключевых элементов для промышленности, самый используемый цветной металл в мире. Земная кора состоит из алюминия на 8 %. Он плавится при +660 градусах. Низкая плотность (всего 2,6 грамма на куб. см), устойчивость к коррозии за счет образования плотных оксидных пленок позволяют эксплуатировать алюминий в аэрокосмической промышленности, при конструировании судов, автомобилей, катеров.
Этот металл относится к группе легких, хорошо проводит тепло и электрический ток. Впервые алюминий был получен в 1825 году датчанином Эрстедом. Позднее другой химик Велер использовал калий для восстановления другого чистого металла.
Кадмий

Кадмий — тягучий и ковкий металл в бело-серебристом окрасе. Он плавится при +321 градусе, а закипает — при 765 градусах Цельсия. В 1817 году немец Штромейер открыл кадмий при исследовании свойств цинковых оксидов. Металл получил название по греческому обозначению руды. Кадмий прочнее олова, но поддается резке ножом. Теряет упругость он при +80 градусах Цельсия.
Кадмий используют при создании солнечных батарей, нанесении антикоррозийных покрытий на иные металлы, при производстве аккумуляторов.
Олово

Сравнительно пластичный металл в белом цвете с серебристым отливом. Он наименее твердый из всех перечисленных материалов. Олово плавится при +232 градусах Цельсия, не окисляется, не ржавеет при комнатной температуре. Особенно часто его используют в сплавах — припоях, где содержание самого металла не превышает 60 %. Вместе с медью олово образует бронзу — один из наиболее ценных материалов.
К сферам применением олова относят электронику, изготовление пищевой тары, производство белой жести, подшипников, трубопроводов.
Самые легкие металлы в мире
Слово «металл» привычно ассоциируется с большим весом. Но это совсем не так – некоторые металлы настолько легкие, что даже не тонут в воде. А некоторые весят в сотню раз меньше пенопласта и все равно остаются прочным металлом. Возможно, вас также заинтересует статься про самые дорогие металлы в мире.

Самый легкий металл в мире
Литий
Самый легкий металл, известный науке, это, безусловно, литий. Как и остальные легчайшие металлы, он относится к группе щелочных металлов, которой свойственная высокая химическая активность. Плотность лития – 0,534 грамма на кубический сантиметр, т.е. он почти вдвое легче воды. Более того, литий может плавать даже в керосине, поэтому для его хранения, как правило, используют минеральное масло, петролейный эфир, газолин или парафин.

Литий в 40 раз легче одних из самых тяжелых и прочных металлов, известных науке, – осмия и иридия (22,587 г/см3). Молярная масса лития — 6,941 г/моль. Порядковый номер в таблице Менделеева – 3. Литий был выделен из минерала петалита шведским химиком Иоганном Арфведсоном в 1817 году. В природе литий встречается преимущественно в составе горных пород (примерно 21 грамм на тонну). Спустя семь лет литий впервые синтезировали лабораторным путем. Внешне этот пластичный и мягкий металл напоминает лед и даже имеет схожий серебристый оттенок. Чтобы расплавить литий, потребуется температура в 181 C0.
В чистом виде этот легкий металл не используется, так как он чересчур активно взаимодействует с окружающей его средой. Обычно литий сплавляют с натрием или другими легкими металлами. Без лития не обходятся при изготовлении пиротехники, термоядерного оружия, оптики; также литий часто используется в качестве окислителя. Активное применение литию нашли в фармацевтике, пищевой, текстильной и силикатной промышленности. Некоторые сплавы лития оказались полезными даже в электронике и авиакосмической промышленности.

Другие металлы щелочной группы также относят к самым легким, хотя они и уступают литию. Следом за литием идут калий (0,856 г/см3) и натрия (0,971 г/см3). Они также не тонут в воде. Остальные щелочные металлы (рубидий, цезий, франций) тяжелее воды.
Самый легкий и прочный металл
Алюминий
В поисках золотой середины между легкостью и прочностью большинство химиков сходятся во мнении – таковым металлом является алюминий.

Алюминий был открыт в 1825 году датчанином Эрстедом. Первым изделием, изготовленным из алюминия, стала детская погремушка. С тех пор неприхотливому в обработке металлу нашлось столь широкое применение, что это вещество по праву получило звание металла XX века. Из него производят все, без чего нельзя представить наш современный быт: от строительных конструкций до садового инвентаря, фурнитуры и столовых приборов.
Самый легкий искусственный металл
Микролаттис
Известно, что самый легкий природный металл – литий. Однако в 2015 году ученые Калифорнийского университета продемонстрировали сверхлегкий материал по прочности схожий с металлами, но в сотню раз легче пенопласта. Он на 99,99% состоит из воздуха. При этом толщина его стенок составляет всего 100 нанометров – в тысячу раз тоньше человеческого волоса.
Если положить кусок микролаттиса на одуванчик, цветок, чью «шапку» может разрушить даже легкое дуновение ветерка, не деформируется.

Структура микролаттиса напоминает человеческие кости. Материал имеет такую же ячеистую структуру, состоящую из полых никелевых трубок, пересекающихся крест-накрест. Благодаря строению материал способен выдерживать колоссальные для своего веса нагрузки.

Компания Boeing незамедлительно объявила о намерении использовать микролаттис для «самолетов будущего».
Читайте также:
- План характеристики металла и неметалла
- Итальянские рок группы металл
- Ученый основатель электрохимического способа получения металлов
- Холодильник фармацевтический с металлической дверью и замком
- Коляски с металлическими колесами
Самый активный металл — это какой?

Первый образец металлического лития был получен благодаря работе Гемфри Дэви. С помощью электрического тока он разложил расплав гидроксида этого щелочного металла. Через некоторое время Леопольд Гмелин проэкспериментировал с литиевосодержащими солями. Он смог выявить, что они окрашивают пламя в темный цвет.
Основная заслуга в открытии нового химического элемента и росте его популярности принадлежит Иоганну Августу. В 1817 году он нашел новое вещество в составе петалита, алюмосиликата. Через некоторое время литий нашли и в других минеральных образованиях. Такое название он получил из-за того, что впервые был найден в камнях. Название камня по гречески — «литос».
Петалит (Фото: Instagram / lopatkin_oleg)
Промышленное получение
Для получения лития промышленными способами сначала происходит подготовка расходного сырья — минералов или солевых растворов, которые добываются из соляных озер. Независимо от способа добычи расходного сырья, на выходе получается Li2CO3, который будет проходить промышленную обработку.
Читайте также: Классификация цветных и черных металлов
Способы получения расходного сырья:
- электролиз;
- восстановление;
- рафинирование.
Выбор промышленного способа получения щелочного металла зависит от наличия оборудования, требуемого результата, вида расходного сырья.
Рафинирование (Фото: Instagram / krasnoyarsk.science)
Свойства
Свойства элемента известны ученым давно. По сравнению с другими щелочными металлами он имеют ряд уникальных особенностей, по которым определяются основные сферы применения этого вещества.
Химические
- молярная масса — 6,941;
- валентность — 1;
- электроотрицательность — 1;
- атомный номер — 3;
- ковалентный радиус — 1,23 А;
- теплоемкость — 3,307 кДж/(кг·°С).
Литий проявляет стабильность находясь на воздухе. Из группы щелочных металлов он наименее активный. Про взаимодействии с сухим воздухом и кислородом практические не реагирует (при условии соблюдения комнатной температуры).
Взаимодействие лития с водой проходит относительно спокойно. При контакте с водой он начинает образовывать щелочь, выделять кислород. Металл плавает на поверхности жидкости, быстро растворяясь и издавая характерное шипение.
При влажном воздухе металл вступает в реакции с газами, которые содержатся в нем (особенно с азотом). Оксидная пленка покрывает поверхности лития при нагревании до 100–300°C. Пленка защищает металл от окислительных процессов.
При реакции с серой образуется сульфид (при условии нагревания до 130°C). С кремнием вступает в реакцию при нагревании до 700°C. Растворяется в жидком аммиаке, образуя раствор синего цвета.
Литий нельзя хранить в керосиновой жидкости. Из-за малой плотности материал всплывет на поверхность. Для хранения подойдет минеральное масло, газолин, парафин. Емкость лучше выбирать из жести. Она должна герметично закрываться.
Сера (Фото: Instagram / mineral.kirka.shop)
Физические
- Плотность — 539 кг/м3 (при условии, что температура окружающей среды не превышает 20°C).
- Теплопроводность — 70,8 Вт/(м•К).
- Электрическое сопротивление — 9,29•10-8.
- Линейное расширение — 5,6•10-5 К-1.
- Температура плавления — 180,5°C.
- Предел прочности на растяжение — 116 Мпа.
- Температура кипения — 1340°C.
Показатель относительного удлинения — 70%.
Литий — мягкий, пластичный металл. Проще всего обрабатывается с помощью прокатки, прессования.
Список «невесомых» металлов
Тяжесть зависит от плотности и размеров атомов. Чем меньше первый показатель и чем больше второй – тем химический элемент легче. Не нужно быть великим химиком, чтобы выстроить претендентов в структурированный список. Намного интереснее узнать, какие полезные свойства имеют такие металлы и, какое применение находят в жизнедеятельности человека.

Читайте также: Станок для изготовления крученого троса
Литий
Литий является самым легким щелочным металлом. Если сравнивать молекулярные массы Li и H2O, то оказывается, что металл легче воды в два раза. Нередко возникает вопрос, где хранить этот ценнейший элемент, ведь он легко вступает в реакцию с кислородом, окисляясь. Для этого специалисты используют парафин или петролейный эфир.
Удивительно, но литий в чистом виде напоминает консистенцию масла, поэтому легко режется обычным кухонным ножом.
Изначально металл выводили из петалитана. Позже, в 1824 году химики начали синтезировать литий в лабораторных условиях. Сложность добычи заключается в том, что содержание Li в горных породах равно 21 грамму на 1 тонну.
8 интересных фактов о планетах Солнечной системы
Применение в чистом виде лития практически невозможно. А все потому, что он активно взаимодействует с окружающей средой. Чаще его используют в виде сплавов с другими элементами. В производстве такие химические соединения принимают участие в создании оптических приборов, оружия, пиротехники. Благодаря свойствам окисления, Li используется при изготовлении лекарств, текстиля. Невозможно представить себе и электрические приборы без этого металла. А недавно его полезные свойства оценила авиакосмическая промышленность.
Недостаток лития пагубно сказывается на работе ЦНС. Принимать лекарственные средства с содержанием этого биологически полезного компонента рекомендовано людям с болезнью Альцгеймера и другими расстройствами психики.
Калий
Второе место по молекулярной массе занимает 19 элемент в периодической таблице Менделеева. Так же как и Литий, он не встречается в виде самородков, ввиду повышенной активности, поэтому калий выводят из минералов.
Он очень мягок, имеет серебристую окраску, а при горении наблюдается пламя фиолетового цвета. Калий взаимодействует с кислородом, кислотами, водой. Нередко даже случаются взрывы, поэтому работа с этим опасным металлом требует повышенного внимания и использования защитных средств. Если частицы калия попадут на кожу, то вызовут сильнейший химический ожог. Хранить его следует в герметичных емкостях, с добавлением веществ, препятствующих попаданию кислорода. Это может быть силикон, минеральное масло.
Полученный из горных пород калий в чистом виде используют:
- Для изготовления электродов;
- В лампах, фотоэлементах.
10 самых жарких мест на Земле
Читайте также: Как сделать нож своими руками — мастер класс
В виде сплавов же калий находит применение:
- При синтезировании супероксида;
- В работах по установлению возраста горных пород;
- В качестве индикатора в биологии и медицине;
- Как теплоноситель в реакторах.
Наибольшую востребованность в различного вида сплавах калий получил именно в медицине. Значительная часть лекарственных препаратов, так или иначе, синтезируется на основе этого металла. Например, йодистый К, бромид К, хлористый К. Кроме того, он является основой витаминизированных комплексов, направленных на поддержку состояния сердечно-сосудистой системы и кислотно-щелочного баланса в организме.
Натрий
Это неорганическое вещество так же является щелочным и не встречается в природе в чистом виде. Содержится в минералах: бура, тенардит, галит и другие. В лабораторных условиях натрий получают с помощью расплава поваренной соли. Причем в результате такого промышленного способа синтезируется и хлор.
Как и литий с калием, металл бурно реагирует на кислород, кислоты, углекислый газ, спирты. Может самовоспламеняться, если его смешать с фтором или хлором. При добавлении воды случается небольшой взрыв и образование едкого натрия.
По внешнему виду сильно напоминает калий. Имеет серебристый цвет, правда на открытом воздухе моментально тускнеет. Из полезных характеристик для промышленности отмечают отличную проводимость тока и тепла.
Натрий может похвастаться самой большой разницей между температурами кипения и плавления. Так, первый процесс происходит при +883 °С, а второй при +98 °С. Этим свойством обусловлено применение натрия в атомных реакторах, поскольку он выдерживает критические температуры.
В жизнедеятельности человеческого организма Na необходим для нормального обмена веществ. Недостаток полезного элемента приводит к невралгии, проблемам с ЖКТ. А вот переизбыток сулит повышенное давление и отеки.
Самые интересные факты о космосе и его тайны
Алюминий
Самый прочный металл среди легких и цветных – алюминий. Этот элемент отождествляет золотую середину, когда требуется не только невесомый материал, но и устойчивый к различного рода воздействиям.
Детская погремушка — первое изделие из алюминия.
Это один из немногих химических элементов, который принимает непосредственное участие в производстве всего, что составляет современный быт. Самый популярный в мире металл получил звание полезнейшего в XX веке. Хотя, в XXI мало что поменялось. Алюминиевые сплавы (более твердые, чем чистый металл) используют в строительстве, изготовлении столовых приборов, инструментов, мебели и многого другого.
Искусственный металл
В 2020 году калифорнийские ученые создали микролаттис. На сегодня это самый легкий металл на Земле, он состоит из воздуха на 99,99%. Однако элемент обладает уникальной прочностью, ввиду особой конструкции. Это сплетение трубочек, каждая из которых по размерам равна 0,001 человеческого волоса. Удивительные свойства микролаттиса пока только начинают полноценно использовать в промышленности.
Сферы применения
Используется при изготовлении:
- Термоэлектропреобразователей.
- Высокоэффективных лазеров.
- Пиротехники. С его помощью окрашивают пламя фейерверков в красный цвет.
- Припоев.
- Металлогалогеновых ламп, щелочных аккумуляторов.
- Смазочных материалов.
- Стекла, покрытий для фарфоровых изделий.
Основные сферы применения:
- ядерная энергетика;
- металлургия;
- медицина.
Перхлорат щелочного металла используется в качестве окислителя.
Аккумулятор (Фото: Instagram / aspil_energy)
Самый легкий металл
В сознании многих людей закрепилось мнение о металлах как о прочных, твердых и тяжелых веществах. Некоторые из них совершенно не подходят подданное описание. Существует ряд металлов, которые обладают небольшой прочностью и чрезвычайной для этих элементов легкостью. Они даже могут плавать на поверхности воды.
Самый легкий металл в мире – литий. При комнатной температуре его плотность является самой низкой. Она уступает воде практически в два раза и составляет 0,533 грамма на кубический сантиметр. Благодаря маленькой плотности он всплывает в воде и керосине.
Литий содержится в морской воде и верхней континентальной коре. В больших количествах самый легкий металл присутствует в звездном объекте Торна-Житкова, который состоит из сверхгиганта и красного гиганта.
При нормальных условиях литий представляет пластичный ковкий серебристый металл, настолько мягкий, что его можно разрезать ножом. Плавится при температуре 181 градус по Цельсию. Он токсичен и активно взаимодействует с окружающей средой, поэтому не используется в чистом виде.
ЛИТИЙ — в космосе, на земле, под водой
Лёгкими называют металлы, которые обладают небольшой плотностью. Это отнюдь не редкое явление. Вещества с такими характеристиками составляют примерно 20 % от массы земной коры. Они активно добываются и широко применяются в промышленности.
Самым лёгким металлом является литий. Кроме наименьшей атомной массы, он обладает и наименьшей плотностью, которая в два раза ниже, чем у воды. После лития идут калий, натрий, алюминий, рубидий, цезий, стронций и т. д. В их число входит и титан, который обладает самой высокой прочностью среди металлов.
Легкостью и прочностью обладает также алюминий. В земной коре он третий по распространённости. Пока люди не научились получать его промышленным путём, металл был дороже золота. Сейчас килограмм алюминия можно купить примерно за 2 доллара. Его применяют как в ракетной технике и военной промышленности, так и для изготовления пищевой фольги и кухонных предметов.

Сплавы с участием легких цветных металлов
В чистом виде цветмет находит применение не так часто, как в качестве составляющих разнообразных сплавов. К примеру, хорошо знакомая бронза есть не что иное, как сочетание меди с алюминием, оловом, марганцем, свинцом и рядом других элементов. За счет хороших литейных характеристик материал широко используется для изготовления сантехнического оборудования (вентилей, кранов), осветительных устройств, предметов декора и прочих изделий.
Читайте также: Процесс выбора ручного сварочного экструдера
Силумин также обладает высокими литейными характеристиками, сочетает свойства алюминия и кремния – пластичность, гибкость, твердость. Путем модифицирования эти механические характеристики силуминов можно заметно улучшить, благодаря повышению степени дисперсности кристаллов. Еще один сплав с алюминиевой основой – дюралюминий. Наряду с алюминием здесь присутствуют марганец, медь, кремний, магний и другие элементы, относящиеся к разным группам. Технические свойства дюралюминия повышаются посредством термической обработки.
Литий
Литий находится в первой группе периодической таблицы элементов. Он стоит под номером 3, после водорода и гелия, и обладает самой маленькой атомной массой среди всех металлов. Простое вещество – литий, при нормальных условиях имеет серебристо-белый цвет.
Это самый лёгкий щелочной металл с плотностью 0,534 г/см³. Из-за этого он всплывает не только в воде, но и в керосине. Для его хранения обычно используют парафин, газолин, минеральные масла или петролейный эфир. Литий очень мягкий и пластичный, легко режется ножом. Чтобы расплавить этот металл, его нужно нагреть до температуры 180,54 °C. Закипит он только при 1340 °C.
В природе существует только два стабильных изотопа металла: Литий-6 и Литий-7. Кроме них, есть 7 искусственных изотопа и 2 ядерных изомера. Литий является промежуточным продуктом в реакции превращения водорода в гелий, участвуя, таким образом, в процессе образования звёздной энергии.

Литий (Li)
Вот и дошло дело до элемента, который является самым легким в мире металлом. Плотность лития, расположенного в периодической таблице на месте под цифрой 3, равна всего 0,5 г/см^3, что меньше этого показателя у воды, так что чистый литий не тонет. Атомная масса элемента колеблется от 6,398 до 6,997 а. е. м. в зависимости от изотопа. Открыт в 1817-м, а в металлическом виде получен спустя всего год.
Характеризуется повышенной химической активностью и потому в природе легко образует сложносоставные соединения. Пластичен, хорошо обрабатывается прокаткой и прессом. Цвет — серебристый. При комнатной температуре с кислородом реагирует слабо. Воспламенение происходит при 300 °C.

Литий, фото: https://ru.m.wikipedia.org/
В природе встречается в породообразующих минералах и в отложениях озер с сильным содержанием солей. Среди разрабатываемых месторождений наиболее известны чилийские, австралийские и аргентинские, хотя встречаются таковые и на территории других стран, в том числе Китая. В России главное скопление пород с содержанием лития — в Мурманской области. В стране с 2021 года работает в формате эксперимента установка по добыче металла из руд с низким содержанием элемента, благодаря которой процедура возможна при незначительных финансовых и трудовых затратах.
Соли лития используются при создании лазерного оборудования и оптики, в качестве окислителей и восстановителей в химпроме, а также в медицине и различных отраслях промышленности, включая текстильную (как отбеливатели), пищевую (как консерванты) и косметическую. Литиевые сплавы применяются для изготовления высокоэффективных проводников, в том числе анодов, необходимых для электролиза.
Элемент применяется также при создании аккумуляторов, в том числе и щелочных, а не только твердотельных. В малых количествах литий потребен человеческому организму, поскольку участвует в обмене веществ, а также влияет на психоэмоциональную возбудимость и иммунную защиту.
Реакции с литием
Учитывая его щелочную природу, можно предположить, что он очень активен. Однако металл является самым спокойным представителем своей группы. При нормальной комнатной температуре литий слабо реагирует с кислородом и многими другими веществами. Свой «бурный нрав» он проявляет после нагревания, тогда он вступает в реакцию с кислотами, различными газами и основаниями.
В отличие от других щелочных металлов с водой он реагирует мягко, образуя гидроксид и водород. С сухим воздухом реакции практически нет. Но если он влажный, то литий медленно реагирует с его газами, образуя нитрид, карбонат и гидроксид.
При определённых температурах самый легкий металл активен с аммиаком, этиловым спиртом, галогенами, водородом, углеродом, кремнием, серой.

Читайте также: МАЛОГАБАРИТНЫЙ СВЕРЛИЛЬНЫЙ СТАНОК ПРЯМОГО ПРИВОДА
Металлопрокат
К легким относятся металлы, плотность которых менее 4500 кг/м3. К наиболее широко применяемым легким металлам относятся алюминий, магний и титан.
— серебристо-белый с несколько тусклой, покрытой пленкой окиси поверхностью металл. Его плотность 2700 кг/м3, температура плавления 660°C. Основными свойствами алюминия является легкость, пластичность, высокая электро- и теплопроводность, морозостойкость, коррозионная и химическая стойкость (устойчив против действия органических и азотной кислоты), хорошая свариваемость и обработка прокаткой, ковкой и волочением.
Алюминий — самый распространенный в земной коре металл. Однако из-за высокой химической активности в свободном состоянии в природе не встречается, а сосредоточен в бокситах, нефелинах, каолинах, алунитах и др. Наиболее ценная руда, содержащая до 50 % окиси алюминия,— бокситы. Полупродукт химической переработки алюминиевых руд — глинозем. Из него посредством электролиза получают металл.
Технический алюминий выпускается в чушках. В зависимости от химической чистоты различают следующие марки алюминия:
§ особой чистоты — А999 (примесей не более 0,001 %);
§ высокой чистоты — А995, А99, А97, А95 (примесей 0,005—0,05%);
§ технической чистоты — А85, А8, А7, А6, А5, АО, AE (примесей 0,15—1,0%).
Алюминий особой чистоты применяется в полупроводниковой и ядерной технике, высокой чистоты — для изготовления электрических конденсаторов, химической аппаратуры, технической чистоты — для изготовления кабельных изделий, проката, посуды, алюминиевого порошка и пудры, а также сплавов.
Как конструкционный материал алюминий в основном используется в виде сплавов. Это объясняется его невысокими механическими свойствами, труднообрабатываемостью резаньем, а также значительной линейной усадкой. Основными компонентами алюминиевых сплавов являются марганец, медь, кремний, магний, цинк, титан, хром и др.
Алюминиевые сплавы подразделяются на деформируемые (для изготовления листов, лент, труб, профилей и др.), литейные (для получения отливок), припои (для пайки алюминиевых сплавов) и подшипниковые.
Деформируемые
алюминиевые сплавы обладают высокой пластичностью, вследствие чего легко поддаются обработке давлением, хорошо свариваются, устойчивы против коррозии. В зависимости от способности упрочняться термической обработкой они подразделяются на сплавы не упрочняемые и упрочняемые термообработкой (закалкой, старением, отжигом).
К сплавам, не упрочняемым термообработкой, относятся технический алюминий (АД0 и АД1), а также сплавы алюминия с магнием (магналии) или марганцем (АМг2, АМг3, АМг5, АМг6, АМц). Они упрочняются только холодным деформированием и применяются для сварных и клепаных деталей конструкций, эксплуатируемых при сравнительно небольших нагрузках и в коррозионно-активных средах. К сплавам, упрочняемым термообработкой, относятся дуралюмины, авиали, высокопрочные, ковочные и жаропрочные.
Дуралюмины — это сплавы алюминия с медью, магнием и марганцем Они выпускаются марок Д1, Д16п; Д18п, ВД17, Д19, В65 и применяются для изготовления деталей средней и повышенной прочности, подвергающихся переменным нагрузкам (детали самолетов, автомобилей, строительные конструкции и др.).
Читайте также: Состав порошка для порошковой окраски
Авиали — сплавы алюминия с магнием и кремнием Они выпускаются марок AB, АД31, АД33, АД35 и применяются для изготовления деталей средней прочности, а также деталей, подвергающихся гибкой деформации как в холодном, так и в горячем состоянии (лопастей, винтов вертолетов, деталей двигателей, переборок судов, корпусов электромоторов, трубопроводов и др.).
Высокопрочные — это сплавы, состоящие из алюминия, цинка, магния, меди, марганца и хрома. Они выпускаются марок В92, В93, В94, В95, В96, ВАД23. Их недостаток — пониженная коррозионная стойкость.
Ковочные сплавы отличаются высокой пластичностью при температурах 380—450°C и поэтому применяются для изготовления штамповок и поковок сложной формы, средней и повышенной прочности, невысокой коррозионной стойкости. К ним относятся сплавы марок АК6, АК8.
Жаропрочные сплавы применяются для изготовления деталей, работающих при температуре до 300°C (головки блока цилиндров, поршни, детали компрессоров и турбореактивных двигателей, обшивка сверхзвуковых самолетов и др.). К ним относятся сплавы марок АК2, АК4, АК4-1, Д20 и Д21.
алюминиевые сплавы обладают высокой жидкотекучестью, небольшой усадкой, хорошими механическими свойствами и сопротивляемостью коррозии, что достигается введением в их состав большего, по сравнению с деформируемыми сплавами, количества легирующих элементов.
В зависимости от основных компонентов литейные алюминиевые сплавы выпускаются пяти групп, в том числе сплавы на основе алюминия и магния (АЛ8, АЛ13, АЛ22, АЛ23, АЛ27, АЛ29), алюминия и кремния (АЛ2, АЛ4, АЛ4В, АЛ7, АЛ78, АЛ9, АЛ9В), алюминия и меди (АЛ7, АЛ7В, АЛ 19), алюминия, кремния и меди (АЛ3, АЛ5, АЛ6, АЛ10В, АЛ4М, АЛ32 и др.) и многокомпонентные (АЛ1, АЛ 16В, АЛ17В, АЛ18В, АЛ20, АЛ21, АЛ24, АЛ25, АЛ26, АЛ30).
Наиболее распространенными литейными алюминиевыми сплавами являются силумины (сплавы на основе алюминия и кремния).
Для улучшения характеристик литейных алюминиевых сплавов производят их рафинирование (обработку смесью хлористых и фтористых солей калия и натрия или нейтральными газами (азотом, хлором, аргоном) с целью снижения содержания газов и неметаллических примесей) или модифицирование (обработку смесью фтористых и хлористых солей натрия с целью улучшения структуры силуминов и повышения их механических и литейных свойств).
Подшипниковые
алюминиевые сплавы выпускаются марок А03—1, А09—2, А020—1 и др.
В маркировке алюминиевых сплавов буквами обозначаются компоненты (А — алюминий, К — кремний, Мц — марганец, Mг — магний), назначение (Д — деформируемые, Л — литейные) или свойства (В — высокопрочный, M — мягкий отожженный, Π — полунагартованный, H — нагартованный). Буквой Д обозначаются также дуралюмины. Цифры, следующие за буквами маркировки, обозначают или порядковый номер сплава, или процентное содержание соответствующего элемента. У высокопрочных сплавов на первом месте цифровой маркировки проставляется цифра 9.
Магний — серебристо-белый, покрытый окисной пленкой, металл плотностью 1740 кг/м3, температурой плавления 651°C. Основными свойствами магния являются малая плотность (один из самых легких металлов), хорошая обрабатываемость резаньем, стойкость к действию керосина, бензина и минеральных масел, однако он не стоек в водных растворах солей, кроме фтористых, и растворяется во многих кислотах. Магний немагнитен, имеет невысокие литейные и упругие свойства, корродирует во влажном воздухе. Порошкообразный магний или магниевая лента легко загорается от спички и горит белым пламенем.
В природе магний встречается в виде карбонатов, силикатов, хлоридов и сульфатов. Для его получения используют магнезит, доломит, карналлит, бишофит и отходы некоторых производств.
Магний выпускается марок Мг96 (не менее 99,96 % Mg), Мг95 (не менее 99,95% Mg) и Мг90 (не менее 99,90 % Mg) в виде чушек массой до 8 кг. Он примениется в качестве компонента сверхлегких и жаропрочных сплавов, высокопрочного чугуна, в химической промышленности и пиротехнике.
Магниевые сплавы
представляют собой соединения магния с алюминием, цинком, марганцем и другими металлами. Они выпускаются
литейные
(МЛ2, МЛ15, МЛ19) и
деформируемые
(MAl, МА2, МА8 и др.). Цифра в маркировке обозначает порядковый номер, зависящий от химического состава.
Титан — металл серебристого цвета с голубоватым отливом плотностью 4505 кг/м3, температурой плавления 1668°C. Он отличается высокими прочностными свойствами (при температурах до 400°C), коррозионной устойчивостью, в том числе и во многих агрессивных средах, малой тепло- и электропроводностью, немагнитен. Механические свойства титана снижаются при нагреве до температур свыше 400°C, а при температуре 540°C он становится хрупким.
Исходным сырьем для производства титана является ильменит, рутил, сфен или титанит, перовскит и др.
Технический титан
выпускается марок BT1-00 (99,53% Ti), BT1-0 (99,48% Ti) i BT1-1 (99,44% Ti). Чем меньше примесей, тем ниже прочность, но выше пластичность Технический титан хорошо обрабатывается давлением, сваривается (в среде аргона), однако его обработка резаньем затруднена.
Для повышения механических свойств и коррозионной стойкости титан легируют алюминием, молибденом, ванадием, марганцем, хромом, оловом, ниобием и др. Получаемые сплавы по прочности подразделяются на повышенной пластичности, невысокой
и
средней прочности
и
высокопрочные, а
по назначению — на
литейные
(BT1Л, ВТ5Л, ВТ6Л и др.) и
деформируемые
(от 4—0, ВТ5—1, ВТ8, ВТ9, ВТ22 и др.) Цифры в маркировке показывают среднее процентное содержание компонентов сплава.
Титановые сплавы
применяются в химическом машиностроении (колонны, башни, адсорберы, фильтры, насосы, теплообменники, работающие в среде хлора и его растворов, в азотной кислоте), самолетостроении (обшивка самолетов, детали двигателя), ракетной технике, судостроении, тяжелом и энергетическом машиностроении, для изготовления бытовых приборов и др.
Читайте также: Токарно-винторезный станок 1М61
Сплавы лития
Свойства лития повышают отдельные качества металлов, из-за чего его часто используют в сплавах. Полезной является его реакция с окислами, водородом, сульфидами. При нагревании он образует с ними нерастворимые соединения, которые легко извлечь из расплавленных металлов, очистив их от этих веществ.
Для придания сплаву стойкости к коррозии и пластичности его смешивают с магнием и алюминием. Медь в сплаве с ним становится более плотной и менее пористой, лучше проводит электричество. Самый легкий металл повышает твёрдость и пластичность свинца. При этом он повышает температуру плавления многих веществ.
Благодаря литию металл становится прочным и устойчивым к разрушениям. При этом он не утяжеляет их. Именно поэтому сплавы на его основе применяются в космической инженерии и авиации. Главным образом используются смеси с кадмием, медью, скандием и магнием.
Группа легких цветных металлов
К наиболее распространенным способам классификации цветмета по его физико-химическим свойствам относится распределение на семь групп, среди которых выделяются так называемые тяжелые и легкие цветные металлы. Данное условное определение основано на показателе плотности материала. В основной список входят алюминий, магний, титан, литий, олово, бериллий. К этой же группе относятся кадмий, таллий, галлий, висмут, индий и другие элементы. Производство легких сплавов является крайне энергозатратным, поэтому предприятия, специализирующиеся на этой области металлургии, размещаются непосредственно вблизи источников дешевой энергии.
Нахождение в природе и значение
Самый легкий металл имеет около 30 собственных минералов, но только 5 из них используются в промышленности: пенталит, амблигонит, лепидолит, циннвальдит и сподумен. Кроме того, находится он в солёных озёрах. Всего в земной коре содержится 0,005 % этого металла.

Большие промышленные запасы лития находятся на всех континентах. Его добывают в Бразилии, Австралии, ЮАР, Канаде, США и других странах. После чего применяют его в электронике, металлургии, лазерных материалах, ядерной энергетике и даже медицине.
Большое содержание лития есть в гумусах, что говорит о его участии в круговороте природных веществ. Металл присутствует в организме животных, а также во многих растениях. Литием богаты персики, грибы, редис, картофель, морковь.
В нашем организме он содержится в печени, крови, лёгких, костях и других органов. Недостаток лития приводит к нарушениям в работе нервной системы и мозга. Он повышает устойчивость организма к болезням, активизирует деятельность ферментов. С помощью него борются с болезнью Альцгеймера, психическими расстройствами, склерозом, а также различными зависимостями.
Металлы
Впервые человек обнаружил металлы, которые находятся близко к земной поверхности. Сначала это были медь, золото и серебро, позже к ним присоединились олово, железо, бронза и свинец. С развитием человечества список постепенно расширялся. В настоящее время открыто около 94 металлов.

Они представляют собой простые элементы, которые обладаю высокой электропроводностью и теплообменом, пластичностью, поддаются ковке, имеют характерный металлический блеск. В природе они часто встречаются в виде различных соединений и руд.
По своим качествам металлы разделяют на черные, цветные и драгоценные. Для использования их отделяют от руды, проводят чистку, легирование и другие виды обработки. Металлы являются частью живых организмов, присутствуют в морской воде.
В нашем теле они находятся в небольшом количестве, выполняя важные для жизни функции. В печени присутствует медь, кальций — в скелете и зубах, натрий – в цитоплазме клеток, железо является частью крови, а в мышцах находится магний.
Токсичность
Несмотря на важную биологическую роль лития в нашем организме, он может быть опасным. Самый легкий металл достаточно токсичен и способен вызывать отравления. При горении он провоцирует раздражение и отёки слизистых оболочек. Если на них попадет кусочек целого металла, произойдёт то же самое.

Литий нельзя брать в руки без перчаток. Взаимодействуя с влагой в воздухе или влагой на коже, он легко вызывает ожог. С расплавленным металлом нужно быть ещё осторожнее, так как его активность повышается в разы. При работе с ним нужно помнить, что это щелочь. Уменьшить его действие на кожу можно обычным уксусом.
В организме литий повышает устойчивость иммунной системы и улучшает работу нервной системы. Но его переизбыток сопровождается головокружением, сонливостью, потерей аппетита. Отравление металлом приводит к снижению либидо, слабости в мышцах, набору веса. При этом может ухудшиться зрение, память и наступить кома. Работать с литием нужно всегда в перчатках, защитном костюме и очках.
Применение
Литий и его соединения используют:
- В производстве аккумуляторов и батарей.
- В качестве лигатуры в сплавах.
- В ядерной энергетике, радиоэлектронике.
- В медицине (соединения лития используют в лечении подагры, как психотропные, антидепрессанты).
- В пиротехнике (LiNO3 даст фейерверку красный цвет).
Рекомендуем: ОСМИЙ — тяжелее нет металла
Познавательно: добавление LiOH к электролиту в аккумуляторах на 20% увеличивает их емкость, и в 2-3 раза срок службы.
Мировое применение легкого металла распределяется так:
- 56% производство батарей и аккумуляторов;
- 23% керамика и стекло;
- 6% консистентные смазки;
- 2% воздухоочистка;
- 13% прочие.
Интересно: очистка воздуха на подлодках и в космических кораблях происходит с помощью соединений лития (LiBr, LiCl, LiOH).
Источник https://mdmetalla.ru/metall/kakoj-metall-legche-vody.html
Источник https://math-nttt.ru/stanki/kakoj-metall-yavlyaetsya-samym-legkim-2.html
Источник https://th-metall.ru/ustrojstva/metall-legche-vody.html




