Железо. Свойства железа и его соединений
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии :
+26Fe 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6

Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.

(изображение с портала vchemraznica.ru)
Температура плавления 1538 о С, температура кипения 2861 о С.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).

(изображение с портала karatto.ru)
Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).

(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.

(изображение с портала livemaster.ru)
Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
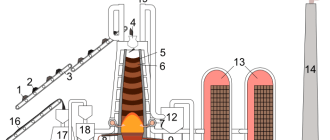
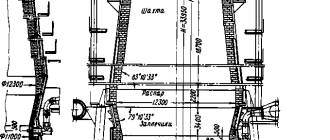
1. Один из основных способов производства железа – доменный процесс . Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
Оксид железа (II) опускается в область с более высоких температур (до 1200 o C), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO

(изображение с портала 900igr.net)
2. Также железо получают прямым восстановлением из оксида водородом:
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами . При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например , хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl

Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.

– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».

Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами . При этом образуется бурый осадок гидроксида железа (III).


Например , хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.

– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».

Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например , хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl

Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно , но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами .
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором . При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900 о С с водяным паром:
3 Fe 0 + 4 H2 + O → Fe +3 3O4 + 4 H2 0
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например , железо бурно реагирует с соляной кислотой :
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей . При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например , при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
2.6. Железо восстанавливает менее активные металлы из оксидов и солей .
Например , железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример : простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2FeCl3 + Fe → 3FeCl2
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.

Способы получения
Оксид железа (II) можно получить различными методами :
1. Частичным в осстановлением оксида железа (III).
Например , частичным восстановлением оксида железа (III) водородом:
Или частичным восстановлением оксида железа (III) угарным газом:
Еще один пример : восстановление оксида железа (III) железом:
2. Разложение гидроксида железа (II) при нагревании :
Химические свойства
Оксид железа (II) — типичный основный оксид .
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например , оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли .
Например , оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например , при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
5. Оксид железа (II) проявляет слабые окислительные свойства .
Например , оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.

Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
Оксид железа (III) – амфотерный .
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например , оксид железа (III) взаимодействует с азотной кислотой:
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит) .
Например , оксид железа (III) взаимодействует с гидроксидом натрия:
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например , хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
5. Оксид железа (III) проявляет окислительные свойства .
Например , оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Также оксид железа (III) восстанавливается водородом:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например , с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.

Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например , хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например , хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства , а именно реагирует с кислотами . При этом образуются соответствующие соли.
Например , гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
3. Гидроксид железа (II) проявляет сильные восстановительные свойства , и реагирует с окислителями. При этом образуются соединения железа (III) .
Например , гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например , хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например , хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов . Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
Но есть исключение ! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Также допустима такая запись:
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами .
Например , гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например , гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
4. Г идроксид железа (III) разлагается при нагревании :
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe 3+ + H2O ↔ FeOH 2+ + H +
II ступень: FeOH 2+ + H2O ↔ Fe(OH )2 + + H +
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например : хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами .
Например , хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы . Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее . Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например , хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
Прямое восстановление железа

Прямо́е восстановле́ние желе́за — это восстановление железа из железной руды или окатышей с помощью газов (СО, Н2, NH3), твёрдого углерода, газов и твёрдого углерода совместно. Процесс ведётся при температуре около 1000 °C, при которой пустая порода руды не доводится до шлакования, примеси (Si, Mn, P, S) не восстанавливаются, и металл получается чистым [1] . В литературе также встречаются термины: металлизация (частичная металлизация) руд, прямое получение железа, бездоменная (внедоменная) металлургия железа, бескоксовая металлургия железа [2] . Продукт процесса называют железом прямого восстановления (DRI от англ. Direct Reduced Iron ).
- 1 История
- 2 Классификация процессов
- 3 Сравнение с доменным процессом
- 3.1 Возможности переработки бедных железных руд
- 3.2 Наличие примесных элементов
- 3.3 Физические свойства руды
- 3.4 Использование недефицитных видов топлива
- 3.5 Использование новых видов энергии
- 5.1 Губчатое железо
- 5.2 Металлизованная шихта
- 5.3 Кричное железо
- 5.4 Чугун или углеродистый полупродукт
История
Попытки получить сталь минуя доменный процесс предпринимались в СССР ещё с 1950-х годов [3] . Промышленное производство железа непосредственно из руды, минуя доменный (с использованием кокса) процесс, появилось в 1970-х годах. Первые установки прямого восстановления железа были малопроизводительны, а конечный продукт имел сравнительно много примесей. Широкое распространение этого процесса началось в 1980-х годах, когда в горно-металлургическом комплексе началось широкое применение природного газа, который идеально подошёл для прямого восстановления железной руды. Кроме того, помимо природного газа, в процессе прямого восстановления железа оказалось возможным использование продуктов газификации углей (в частности бурых), попутного газа нефтедобычи и другого топлива-восстановителя.
Технологические изменения, произошедшие в 1990-е годы, позволили значительно снизить капитало- и энергоёмкость различных процессов прямого восстановления железа, в результате чего произошёл новый скачок в производстве продукции DRI (от англ. Direct Reduction of Iron ) [4] .
Классификация процессов
Доля сталеплавильных процессов в мире: жёлтый — бессемеровский; зелёный — мартеновский; синий — кислородные конвертера; красный — электропечи; розовый — прямое восстановление железа
Схема процесса прямого восстановления железа Krupp-Renn
Схема процесса Midrex
Наиболее предпочтительной, по мнению большинства специалистов, является классификация по виду получаемого продукта:
- получение частично металлизованных (степень металлизации 30—50 %) материалов для доменных печей;
- получение высокометаллизованного продукта (степень металлизации 85—95 %) в твёрдом виде (губчатого железа) для переплавки в сталеплавильных агрегатах с получением стали;
- получение металлизованного продукта в пластическом состоянии (кричного железа) для различных целей, в том числе как вариант пирометаллургического обогащения труднообогатимых, бедных и комплексных руд;
- получение жидкого металла (чугуна или полупродукта) для переплава в сталеплавильных печах [5] .
Сравнение с доменным процессом
Возможности переработки бедных железных руд
Доменный процесс обеспечивает получение кондиционного чугуна из железных руд с любым содержанием железа, при этом содержание железа влияет лишь на технико-экономические показатели процесса. Металлизация бедных руд может быть эффективна лишь для получения кричного железа и жидкого металла. Частично металлизованные материалы и губчатое железо получать из бедных руд неэффективно. При получении частично металлизованных материалов из бедных руд необходимо затратить большее количество тепла на нагрев пустой породы и увеличить расход восстановителя. Производство губчатого железа из руд, содержащих более 2,5—3,0 % пустой породы, приводит к резкому росту расхода электроэнергии в процессе плавки металлизованных окатышей из-за резкого увеличения количества шлака [5] .
Наличие примесных элементов
Доменная печь в состоянии полностью обеспечить получение кондиционного по сере чугуна. Удаление из чугуна меди, фосфора, мышьяка в доменной печи невозможно. Низкотемпературные процессы получения губчатого железа не обеспечивают удаления попутных элементов, то есть все попутные элементы, присутствующие в исходной руде, остаются в губчатом железе и попадают в сталеплавильный агрегат. Это же относится к получению кричного металла (здесь возможна некоторая степень удаления серы). Получение жидкого металла позволяет удалить из процесса летучие элементы (цинк, щелочные металлы), а степень удаления серы, мышьяка и фосфора зависит от режима процесса [6] .
Физические свойства руды
В доменной печи перерабатывают исключительно кусковой железорудный материал, причём размер кусков не должен быть менее 3—5 мм. Отсюда вытекает необходимость процесса окускования руд. Это требование остаётся обязательным для процессов получения губчатого и кричного железа в шахтных и вращающихся печах. Низкотемпературная металлизация измельчённых руд возможна в специальных агрегатах (например, аппараты кипящего слоя). Для большинства способов внедоменного получения жидкого металла размер кусков руды не имеет значения, поэтому возможно исключение из металлургического передела дорогостоящих процессов окускования мелких руд [7] .
Использование недефицитных видов топлива
Современные доменные печи в качестве топлива используют только металлургический кокс. Прежде всего это связано с высокими прочностными качествами кокса, сохраняющимися при высоких температурах. Ни один из известных ныне (2007 год) видов твёрдого топлива не может в этом отношении конкурировать с коксом. Большинство известных способов и технологий металлургии железа не требуют использования кокса в качестве компонента шихты. Могут быть использованы полученные различным способом восстановительные газы (в основном при производстве губчатого железа), недефицитные виды каменного угля, бурые угли и продукты их переработки, нефтепродукты и др. [7]
Использование новых видов энергии
Несмотря на то что использование энергии плазмы, атомной и других новых источников энергии для доменного производства не исключается, наибольший эффект от их применения наблюдается при внедоменном получении металла. Это повышает шансы новых технологий в конкуренции с доменным процессом в будущем [8] .
Технология
Процессы получения губчатого железа осуществляются при умеренных температурах с использованием газообразного или твёрдого восстановителя в различных агрегатах: шахтных, трубчатых, туннельных, муфельных, отражательных, электронагревательных печах, ретортах периодического действия, конвейерных машинах, реакторах с кипящим слоем и др. Иногда эти агрегаты соединены в комплексы, в которых наиболее часто сочетаются с электропечью (электродоменной или дуговой) для получения жидкого металла (чугуна и стали). Чаще всего губчатое железо применяют как высокочистую добавку к стальному лому. Наиболее стабильный спрос на губчатое железо отмечается в странах с недостаточными мощностями доменного производства и поставками стального лома.
Основными процессами, используемыми на работающих, строящихся и проектных установках для производства губчатого железа, являются процессы с применением шахтных печей и реторт периодического действия. Процессы с использованием вращающихся печей и твёрдого восстановителя находят промышленное применение, главным образом, при переработке металлургических отходов — пылей и шламов, которые содержат примеси цинка, свинца и др., а также комплексных железных руд (богатых титаном, хромом, никелем, марганцем и др.), не пригодных для использования в доменных печах. Процессы в кипящем слое получили меньшее распространение в связи с целым рядом специфических особенностей (жёсткие требования к гранулометрическому составу, газодинамические ограничения существования кипящего слоя, температурные условия и др.).
Процессы металлизации в шахтных печах во многом похожи на процессы, протекающие в шахте доменных печей в области умеренных температур. Однако имеются и значительные отличия: в шахтной печи отсутствует кокс; важную роль в процессах восстановления оксидов железа играет водород; восстановительный газ является единственным источником тепла, обеспечивающим все тепловые потребности процесса.
В процессе восстановления окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии газа (твёрдого топлива), которые содержат водород. Водород легко восстанавливает железо:
при этом не происходит загрязнения железа такими примесями как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде и в дальнейшем переплавляется в электрических печах. Для получения тонны железа прямым восстановлением из руды необходимо затратить примерно 1000 м 3 водорода.
По своей сути процесс прямого восстановления железа является восстановлением железа из руд, минуя доменный процесс, то есть кокс в процессе не участвует.
Наиболее отработанным и широко распространённым процессом является процесс Midrex. С 1983 года на Оскольском электрометаллургическом комбинате работают четыре модуля процесса металлизации Midrex общей мощностью 1700 тыс. т металлизованных окатышей в год. В состав каждого модуля входят: шахтная печь металлизации, реформер (реактор конверсии природного газа); система производства инертного газа; система аспирации. Система водного хозяйства, свеча, помещение пульта управления и электроснабжение являются общими для каждой пары модулей.
Шахтная печь для металлизации состоит из загрузочного (промежуточного) бункера; верхнего динамического затвора с загрузочным распределителем и загрузочными трубами; зоны восстановления; промежуточной зоны; зоны охлаждения; огнеупорной футеровки; постоянно действующих питателей; нижнего динамического затвора и маятникового питателя (для выгрузки готового продукта) [9] .
Какова история железа? Время железных криц и первой стали



Способы прямого восстановления железа, характеристика продукции и сырья
Под процессами прямого восстановления железа понимают такие процессы, которые дают возможность получать непосредственно из руды металлическое железо, минуя доменную печь. Способы прямого получения железа позволяют вести процесс не расходуя металлургический кокс, заменяя его другими видами топлива.
Известно, что использование железа прямого восстановления при выплавке стали (в основном, в электродуговых печах) позволяет производить наиболее высококачественный, экономически выгодный (с относительно низкой энергоемкостью) и экологически чистый металл без примесей серы и фосфора, пригодный для удовлетворения самых высоких требований таких отраслей-потребителей, как машиностроение (авиа-, судостроение и т. д.). В настоящее время предложено более 20 различных способов прямого получения железа.
Железо прямого восстановления (или губчатое железо) в основном производят в виде металлизированных окатышей: холодных СDRI (Сool Direct Reduced Iron) или горячих HDRI (Hot Direct Reduced Iron), а также горячебрикетированного железа НBI (Hot Briquetted Iron).

Рис.38. Внешний вид железа прямого восстановления СDRI (а),HDRI (б) и НBI (в)
Окатыши СDRI (рис. 38 а) получают в основном в шахтных печах с охлаждением в нижней части печи до 50º С, после чего отравляются на склад, а затем загружаются в электропечь.
Окатыши HDRI (рис. 38 б) выгружаются из установки прямого восстановления в горячем состоянии и загружаются в расположенную рядом электропечь при температуре 600º С и выше.
Горячебрикетированное железо НBI (рис. 38 в) получается путем прессования брикетов размерами 30×50×110 мм в формы в виде подушек из металлизированного продукта, который выгружается из печи при температуре около 700º С.
Наибольшее распространение получили технологии компании Midrex (США). Процесс протекает в шахтной печи, в верхнюю часть которой подаются окатыши или кусковая руда. Установки Midrex действуют на многих предприятиях крупнейшей металлургической компании ArcelorMittal, расположенных в Германии, Канаде, Мексике, Тринидаде и Тобаго и ЮАР.
Второй по распространенности технологией прямого восстановления железа является HYL/Energiron. Процесс HYL был разработан мексиканской компанией Tenova для прямого восстановления железной руды (кусковой или окатышей) в металлическое железо с помощью восстановительного газа в реакторе с подвижным слоем.
Менее известна технология Finmet, которая позволяет использовать железорудную мелочь без предварительного окускования в процессе газового восстановления в кипящем (псевдосжиженном) слое. По этой технологии пока действует только одно предприятие – Orinoco Iron в Венесуэле.
Для получения железа прямого восстановления также применяется целый ряд угольных технологий – SL/RN, Jindal, DRC, SIIL, Tisco, Codir и др. В основном все они действуют на базе печей с вращающимся подом с использованием угля или пылеугольной смеси.
Читайте также: Как правильно обработать пороги автомобиля после сварки
Такие предприятия работают в Индии, а также в ЮАР, Китае, Перу и в некоторых других странах. Хотя экологичность таких производств и качество получаемого металла существенно ниже, чем у «газовых» предприятий, однако они дешевле, что и обеспечивает им значительную долю в структуре мирового производства DRI.
Существуют также жидкофазные способы прямого восстановления и альтернативные доменной печи установки для получения чугуна.

Рис. 39. Доля способов производства железа прямого восстановления в мире
Структура производства железа прямого восстановления в мире в последние годы приведена на рис. 39.






Железная руда
Для начала стоит рассмотреть способ производство железа из железной руды. Железо – элемент весьма распространенный. По содержанию в земной коре металл занимает 4 место среди всех элементов и 2 среди металлов. В литосфере железо представлено обычно в виде силикатов. Наибольшее его содержание отмечено в основных и ультраосновных породах.
Практически все горные руды содержат какую-то толику железа. Однако разрабатываются лишь те породы, в которых доля элемента имеет промышленное значение. Но и в этом случае количество пригодных для разработки минералов более чем велико.
- Прежде всего, это железняк – красный (гематит), магнитный (магнитит) и бурый (лимонит). Это сложные оксиды железа с содержанием элемента в 70–74%. Бурый железняк чаще встречается в корах выветривания, где формирует так называемые «железные шляпы» толщиной до нескольких сот метров. Остальные имеют в основном осадочное происхождение.
- Очень распространен сульфид железа – пирит или серный колчедан, однако железной рудой он не считается и идет на производство серной кислоты.
- Сидерит – карбонат железа, включает до 35%, это руда средняя по содержанию элемента.
- Марказит – включает до 46,6%.
- Миспикель – соединение с мышьяком и серой, содержит до 34,3% железа.
- Леллингит – включает всего 27,2% элемента и считается рудой бедной.
Минеральные породы классифицируют по доле железа таким образом:
- богатые – с содержанием металла более, чем 57%, с долей кремнезема менее 8–10%, и примесью серы и фосфора менее 0,15%. Такие руды не обогащаются, сразу отправляются на производство;
- руда со средним содержанием включает не менее 35% вещества и нуждается в обогащении;
- бедные железные руды должны содержать не менее 26%, и тоже обогащаются перед отправкой в цех.
Общий технологический цикл производства железа в виде чугуна, стали и проката рассмотрен в этом видео:



Производство железа в шахтных печах (технология Midrex)
В шахтных печах получают губчатое железо газообразными восстановителями в толстом слое железосодержащих окатышей. Схема производства различных видов железа прямого восстановления с использованием шахтной печи приведена на рис. 40.

Рис. 40. Технологическая схема производства железа прямого восстановления в шахтных печах
Процесс производства железа осуществляют в противотоке железорудных материалов, загружаемых в агрегат сверху, и нагретых восстановительных газов, подаваемых снизу. Работа агрегата в противотоке дает возможность достигать высокой производительности при хорошем использовании газа.
В качестве восстановителей применяют конвертированный природный газ, состоящий в основном из водорода (H2) и оксида углерода (CO). Восстановительный газ получают в кислородном реакторе (реформере), путем неполного сжигания природного газа в кислороде. Полученный газ, содержащий 29% CO, 55% H2 и 13% окислителей (H2O и CO2) освобождают частично от окислителей, затем нагревают, до температуры 1100…1150 °С и через фурмы подают в печь.
Добытую руду обогащают и получают окатыши. Окатыши из бункера загружают в шахтную печь, работающую по принципу противотока. Для восстановления железа из окатышей в среднюю часть печи по трубопроводу подают конвертированный природный газ. В восстановительной зоне печи создается температура 1000…1100 °C, при которой H2 и CO восстанавливают железную руду в окатышах до твёрдого губчатого железа. Содержание железа в окатышах достигает 90…95%. Для охлаждения железных окатышей, снизу печи в зону охлаждения печи подают воздух. Охлаждённые окатыши выдаются на конвейер и поступают на выплавку стали в электропечах. Если производятся горячие окатыши или горячебрикетированное железо, то охлаждение восстановленного железа в нижней зоне печи не производится.



Технологи получения железа
Технология получения железа в древности
Для получения железа из руды, сначала нужно получить крицу. Для этого сначала использовалась окисленная железная руда, которая чаще всего залегает у поверхности. После открытия ее свойств такие залежи быстро истощились в результате их интенсивной разработки.
Читайте также: Как за несколько минут расплавить самый тугоплавкий материал в мире?
Болотные руды распространены гораздо шире. Они образовались в субатлантическом периоде, когда в процессе заболачивания железная руда оседала на дно водоемов. Все средневековье черная металлургия использовала болотные руды. Ими даже платили повинности. Получение железа из руды в относительно большом количестве стало возможным после изобретения сыродутного горна. Это название появилось после изобретения дутья подогретым воздухом в доменных печах. В древности же металлурги подавали в горн сырой (холодный) воздух. При температуре 900o с помощью углекислого газа, отнимающего у окиси железа кислород, происходит восстановление железа из руды и получается тесто или бесформенный, пропитанный шлаком пористый кусок – крица. Для осуществления этого процесса был необходим древесный уголь как источник углекислого газа. Крица после этого проковывалась, для того чтобы удалить из нее шлак. Сыродутный способ, иногда называемый варкой железа, неэкономичен, но он долгое время оставался единственным и неизменным способом получения черного металла.
Сначала железо выплавляли в обычных, закрытых сверху ямах, позднее стали строить глиняные печи-горны. В рабочее пространство горна слоями загружали измельченную руду и уголь, все это поджигалось, и через отверстия-сопла специальными (кожаными) мехами нагнетался воздух. Каменная порода оседает в шлак при температуре 1300-1400o, при которой получается сталь – железо, содержащее от 0.3 до 1.2%. углерода. При остывании оно становится очень твердым. Чтобы получить чугун – плавкое железо с содержанием углерода 1.5-5%, – нужна более сложная конструкция горна с большим рабочим пространством. При этом температура плавления железа оказывалась ниже, и оно частично вытекало из горна вместе со шлаком. При остывании оно становилось хрупким, и его поначалу выбрасывали, но потом научились использовать. Чтобы получить из чугуна ковкое железо, нужно удалить из него углерод.
Технология создания железных сплавов
Первым устройством для получения железа из руды была одноразовая сыродутная печь. При огромном количестве недостатков, долгое время это был единственный способ получить металл из руды.
Древние люди долгое время жили богато и счастливо — каменные топоры делали из яшмы, а для получения меди пережигали малахит, но все хорошее имеет тенденцию кончаться. Одной из причин краха античной цивилизации Средиземноморья стало истощение минеральных ресурсов. Золото кончилось не в казне, а в недрах, олово иссякло даже на «Оловянных островах». Хотя медь и добывается на Синае и Кипре до сих пор, но те месторождения, которые разрабатываются сейчас, римлянам доступны не были. Среди прочего, кончилась и пригодная для сыродутной обработки руда. Только свинца ещё было много.
Впрочем, варварские племена, заселившие ставшую бесхозной Европу, долгое время не знали, что недра её истощены предшественниками. Учитывая громадное падение объёма производства металлов, тех ресурсов, которыми римляне побрезговали, долгое время хватало. Позже, металлургия стала возрождаться в первую очередь в Германии и Чехии — то есть, там, куда римляне не добрались с кирками и тачками.
Более высокую ступень в развитии чёрной металлургии представляли собой постоянные высокие печи называемые в Европе штукофенами. Это действительно была высокая печь — с четырёхметровой трубой для усиления тяги. Мехи штукофена качались уже несколькими людьми, а иногда и водяным двигателем. Штукофен имел дверцы, через которые раз в сутки извлекалась крица.
Изобретены штукофены были в Индии в начале первого тысячелетия до новой эры. В начале нашей эры они попали в Китай, а в VII веке вместе с «арабскими» цифрами арабы заимствовали из Индии и эту технологию. В конце XIII века штукофены стали появляться в Германии и Чехии (а ещё до того были на юге Испании) и в течение следующего века распространились по всей Европе.
Производительность штукофена была несравненно выше, чем сыродутной печи — в день он давал до 250 кг железа, а температура плавления в нем оказывалась достаточна для науглероживания части железа до состояния чугуна. Однако штукофенный чугун при остановке печи застывал на её дне, смешиваясь со шлаками, а очищать металл от шлаков умели тогда только ковкой, но как раз ей-то чугун и не поддавался. Его приходилось выбрасывать.
Иногда, впрочем, штукофенному чугуну пытались найти какое-то применение. Например, древние индусы отливали из грязного чугуна гробы, а турки в начале XIX века — пушечные ядра. Трудно судить, как гробы, но ядра из него получались — так себе.
Ядра для пушек из железистых шлаков в Европе отливали еще в конце XVI в. Из литой брусчатки делались дороги. В Нижнем Тагиле до сих пор сохранились здания с фундаментами из литых шлаковых блоков.
Металлурги давно заметили связь между температурой плавления и выходом продукта — чем выше она была, тем большую часть содержащегося в руде железа удавалось восстановить. Потому рано или поздно им приходила мысль форсировать штукофен предварительным подогревом воздуха и увеличением высоты трубы. В середине XV века в Европе появились печи нового типа — блауофены, которые сразу преподнесли сталеварам неприятный сюрприз.
Более высокая температура плавления действительно значительно повысила выход железа из руды, но она же повысила и долю железа науглероживающегося до состояния чугуна. Теперь уже не 10 %, как в штукофене, а 30 % выхода составлял чугун — «свиное железо», ни к какому делу не годное. В итоге, выигрыш часто не окупал модернизации.
Блауофенный чугун, как и штукофенный, застывал на дне печи, смешиваясь со шлаками. Он выходил несколько лучшим, так как его самого было больше, следовательно, относительное содержание шлаков выходило меньше, но продолжал оставаться малопригодным для литья. Чугун получаемый из блауофенов оказывался уже достаточно прочен, но оставался ещё очень неоднородным — из него выходили только предметы простые и грубые — кувалды, наковальни. Уже прилично выходили пушечные ядра.
Кроме того, если в сыродутных печах могло быть получено только железо, которое потом науглероживалось, то в штукофенах и блауофенах внешние слои крицы оказывались состоящими из стали. В блауофенных крицах стали было даже больше, чем железа. С одной стороны, это казалось хорошо, но, вот, разделить-то сталь и железо оказывалось весьма затруднительно. Содержание углерода становилось трудно контролировать. Только долгой ковкой можно было добиться однородности его распределения.
В своё время, столкнувшись с этими затруднениями, индусы не стали двигаться дальше, а занялись тонким усовершенствованием технологии и пришли к получению булата. Но, индусов в ту пору интересовало не количество, а качество продукта. Европейцы, экспериментируя с чугуном, скоро открыли передельный процесс, поднимающий металлургию железа на качественно новый уровень.
Следующим этапом в развитии металлургии стало появление доменных печей. За счёт увеличения размера, предварительного подогрева воздуха и механического дутья, в такой печи все железо из руды превращалось в чугун, который расплавлялся и периодически выпускался наружу. Производство стало непрерывным — печь работала круглосуточно и не остывала. За день она выдавала до полутора тонн чугуна. Перегнать же чугун в железо в горнах было значительно проще, чем выколачивать его из крицы, хотя ковка все равно требовалась — но теперь уже выколачивали шлаки из железа, а не железо из шлаков.
Доменные печи впервые были применены на рубеже XV-XVI веков в Европе. На Ближнем Востоке и в Индии эта технология появилась только в XIX веке (в значительной степени, вероятно, потому, что водяной двигатель из-за характерного дефицита воды на Ближнем Востоке не употреблялся). Наличие в Европе доменных печей позволило ей обогнать в XVI веке Турцию если не по качеству металла, то по валу. Это оказало несомненное влияние на исход борьбы, особенно когда оказалось, что из чугуна можно лить пушки.
С начала XVII века европейской кузницей стала Швеция, производившая половину железа в Европе. В середине XVIII века её роль в этом отношении стала стремительно падать в связи с очередным изобретением — применением в металлургии каменного угля.
Прежде всего надо сказать, что до XVIII века включительно каменный уголь в металлургии практически не использовался — из-за высокого содержания вредных для качества продукта примесей, в первую очередь — серы. С XVII века в Англии каменный уголь, правда, начали применять в пудлинговочных печах для отжига чугуна, но это позволяло достичь лишь небольшой экономии древесного угля — большая часть топлива расходовалась на плавку, где исключить контакт угля с рудой было невозможно.
Среди многих металлургических профессий того времени, пожалуй, самой тяжелой была профессия пудлинговщика. Пудлингование было основным способом получения железа почти на протяжении всего XIX в. Это был очень тяжелый и трудоемкий процесс. Работа при нем шла так: На подину пламенной печи загружались чушки чугуна; их расплавляли. По мере выгорания из металла углерода и других примесей температура плавления металла повышалась и из жидкого расплава начинали «вымораживаться» кристаллы довольно чистого железа. На подине печи собирался комок слипшейся тестообразной массы. Рабочие-пудлинговщики приступали к операции накатывания крицы при помощи железного лома. Перемешивая ломом массу металла, они старались собрать вокруг лома комок, или крицу, железа. Такой комок весил до 50 — 80 кг и более. Крицу вытаскивали из печи и подавали сразу под молот — для проковки с целью удаления частиц шлака и уплотнения металла.
Устранять серу коксованием научились в Англии в 1735 году, после чего возможность использовать для выплавки железа большие запасы каменного угля. Но за пределами Англии эта технология распространилась только в XIX веке.
Потребление же топлива в металлургии уже тогда было огромно — домна пожирала воз угля в час. Древесный уголь превратился в стратегический ресурс. Именно изобилие дерева в самой Швеции и принадлежащей ей Финляндии позволило шведам развернуть производство таких масштабов. Англичане, имевшие меньше лесов (да и те были зарезервированы для нужд флота), вынуждены были покупать железо в Швеции до тех пор, пока не научились использовать каменный уголь.
Электрический и индукционный способы выплавки железа
Разнообразие составов сталей очень затрудняет их выплавку. Ведь в мартеновской печи и конвертере атмосфера окислительная, и такие элементы, как хром, легко окисляются и переходят в шлак, т.е. теряются. Значит, чтобы получить сталь с содержанием хрома 18%, в печь надо дать гораздо больше хрома, чем 180 кг на тонну стали. А хром – металл дорогой. Как найти выход из этого положения?
Читайте также: Определение модуля сдвига и кручения статическим методом
Выход был найден в начале XX в. Для выплавки металла было предложено использовать тепло электрической дуги. В печь круглого сечения загружали металлолом, заливали чугун и опускали угольные или графитовые электроды. Между ними и металлом в печи («ванне») возникала электрическая дуга с температурой около 4000°C. Металл легко и быстро расплавлялся. А в такой закрытой электропечи можно создавать любую атмосферу – окислительную, восстановительную или совершенно нейтральную. Иными словами, можно предотвратить выгорание ценных элементов. Так была создана металлургия качественных сталей.
Позднее был предложен еще один способ электроплавки – индукционный. Из физики известно, что если металлический проводник поместить в катушку, по которой проходит ток высокой частоты, то в нем индуцируется ток и проводник нагревается. Этого тепла хватает, чтобы за определенное время расплавить металл. Индукционная печь состоит из тигля, в футеровку которого вделана спираль. По спирали пропускают ток высокой частоты, и металл в тигле расплавляется. В такой печи тоже можно создать любую атмосферу.
В электрических дуговых печах процесс плавки идет обычно в несколько стадий. Сначала из металла выжигают ненужные примеси, окисляя их (окислительный период). Затем из печи убирают (скачивают) шлак, содержащий окислы этих элементов, и загружают ферросплавы – сплавы железа с элементами, которые нужно ввести в металл. Печь закрывают и продолжают плавку без доступа воздуха (восстановительный период). В результате сталь насыщается требуемыми элементами в заданном количестве. Готовый металл выпускают в ковш и разливают.
Химические реакции при получении железа
В современной промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (Fe3O4).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод кокса окисляется до монооксида углерода (угарного газа) кислородом воздуха:
В свою очередь, угарный газ восстанавливает железо из руды:
3CO + Fe2O3 → 2Fe + 3CO2↑.
Флюс добавляется для извлечения нежелательных примесей из руды, в первую очередь силикатов, таких как кварц (диоксид кремния). Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Против других примесей используют другие флюсы.
Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь):
CaCO3 → CaO + CO2↑.
Оксид кальция соединяется с диоксидом кремния, образуя шлак:
CaO + SiO2 → CaSiO3.
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности, и его можно сливать отдельно от металла. Шлак затем употребляется в строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишний углерод и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используют и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, содержащими водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями как сера и фосфор — обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Производство железа в периодически действующих ретортах (технология HYL/Energiron)
Еще одним способом производства железа прямого восстановления является процесс в периодически действующих ретортах, используемых в качестве агрегатов восстановления. На установке таких реторт четыре (рис. 41). Емкость каждой реторты 100…150 т.

Рис. 41. Схема установки HYL: 1 – десульфуратор природного газа; 2 – установка конверсии; 3 – котел-утилизатор; 4 – барабан для производства пара; 5 – воздушный охладитель; 6 – воздуходувка; 7 – скруббер; 8 – воздухонагреватель; 9 – загрузочный бункер; 10 – нагреватель газа; 11 – реторты (I – IV); 12 – скруббер; 13 – конвейер подачи руды; 14 – конвейер уборки губчатого железа; 15 – сборный бункер губчатого железа
Реторты переставляются с одной позиции на другую, что обуславливает циклический характер процесса, состоящего из последовательных операций загрузки, нагрева и восстановления шихты, охлаждения и выгрузки губчатого железа. Реторты загружают и подают газ сверху. В качестве сырья используют чистые руды, содержащие не менее 60 % железа, крупностью 12…50 мм.
Восстановление ведется в неподвижном слое кусковой руды или окатышей при избыточном давлении 0,35…0,4 МПа и температуре 870…1040 °С. Нагрев руды и компенсация тепловых потерь процесса осуществляют за счет физического тепла восстановительного газа, который нагревают до 980…1240 ºС. При выдержке 4…6 часов средняя степень металлизации железа составляет 85 %. Выгрузку губчатого железа производят снизу с помощью специальных скребков. Губчатое железо поступает на конвейер транспортирующий губку в сталеплавильное отделение. На рис. 42 показана схема стационарной реторты со съемной крышкой и откидным днищем.

Рис. 42. Конструкция реторты: 1 – гидравлический цилиндр; 2 – тележка; 3 – привод; 4 – кожух; 5 – крышка; 6 – загрузочная горловина; 7 – площадка для обслуживания; 8 – резец с рычагом для удаления губчатого железа; 9 – губчатое железо; 10 – футеровка; 11 – механизм управления откидным днищем; 12 – откидное днище; 13 – разгрузочный желоб
В каждой из четырех реторт протекают различные процессы. В одной реторте происходит предварительный нагрев и восстановление шихты газом, выходящим из других реторт. В двух ретортах происходит довосстановление железа подогретым газом, получаемым в конверсионной установке. В четвертой происходит науглероживание губчатого железа. Готовое железо поступает на конвейер, а в освобожденную реторту загружают исходную шихту.
К недостаткам метода относят:
- периодичность процесса;
- неравномерность металлизации по высоте;
- низкая степень металлизации в сравнении с процессами, осуществляемыми в шахтных печах.
История возникновения железа
Железная эра (I тыс. до н.э.) — период ранней истории человечества, который определяется развитием металлургии и использованием железных изделий (ножи, топоры, посуду, оружие, украшения и т.п.).
Железный век в системе трех периодов
Разделение ранней истории человечества на три периода археологических культур: каменный, бронзовый и железный век предложил датский археолог Христиан Юргенсен Томсен для облегчения классификации археологических находок.
Лучше предложена Момсеном классификация артефактов работает для археологических находок Средиземноморья и Ближнего Востока. В других древних культурах, например, культуре Древнего Китая, выделить бронзовый и железный века труднее. Термин «железный век», встречается гораздо раньше, в книге «Труды и дни» Гесиода, где история человечества разделена на 5 эпох: золотая, серебряная, бронзовая, эпоха героев и железная эпоха.
Однако это древнее разделение мифологическое, а не археологическое. Все народы и цивилизации пережили период распространения металлургии и железных изделий. Но к культурам железного века относят только цивилизации ранней истории, которые впоследствии прошли рабовладельческий период.
Продолжительность железной эпохи
Период эпохи железного века — был наименее длительным среди других эпох.
Он начался с Темных времен Греции в 12 веке до н.е. в Европе и на Ближнем Востоке, и в 11 веке в Индии и Азии. Считается, что железная эпоха закончилась с возникновением примерно в 3 веке до Рождества Христова писаной истории, дает нам представление о событиях от непосредственных ее участников (развитый эллинизм и Римское государство).
В Америке, Австралии и Океании железная эра началась лишь с появлением европейцев.
Если так можно выразиться, мы продолжаем жить во времена развитого железного века.
Железо и металлургия не утратили своего значения до сих пор. Еще недавно СССР был несравненным лидером по производству чугуна и стали.
Открытие железа
Ранняя технология получения и обработки железа была примитивной по сравнению с современной металлообработкой. Древнейшие железные артефакты, найденные археологами, были из метеоритного железа, вернее сплава железа с никелем.
Добыча железной руды и выплавление железа началось в конце бронзового века. Вопрос о том, откуда начался этот процесс: существовал ли сначала один центр выплавления железа или эта технология возникла в разных частях мира независимо – дискутируется археологами.
Самая распространенная теория утверждает, что плавление железа зародилось в Восточной Анатолии примерно за 1200 лет до нашей эры.
Первой технологией виплавления железа была сыродутная. В земле выкапывалась яма, куда складывали слоями руду и уголь. Над ямой сооружали купол с дымоходом. Воздух в печь подавалось с помощью кузнечных мехов. Такая конструкция обеспечивала возобновление железа без расплавления — температура была слишком низкой.
Читайте также: Соединения углерода: карбиды, соли, диоксид, угольная кислота
Технология была малоэффективной. В результате, разрушив печь, из нее вынимали пористое вещество, которое называли сталью.
Она состояла из железа и шлака. Ее потом уплотняли с помощью кузнечных молотов. Сыродутное железо было низкого качества и хрупкое. Оно уступало по твердости перед бронзой.
Преимуществом железа над бронзой была доступность сырья.
Скобяные изделия из железа стали лучше за бронзовых только с началом освоения процесса варки стали, что произошло в раннем Средневековье. С тех пор люди начали широко применять железо. А до того скобяные изделия уступали качеством бронзе, но железная руда была доступна и могла быть найдена практически везде, тогда как производство бронзы требует медных и оловянных руд, месторождения которых были далеко и нуждались перевозок и торговли.
С изобретением технологии плавления железа произошли значительные изменения в человеческом обществе — люди получили в достаточном количестве инструменты.
Практически все бытовые скобяные изделия, кроме ножниц и винтов, были впервые изготовлены в железную эру.
Производство железа на движущейся колосниковой решетке
Процесс получения железа на движущейся колосниковой решетке (рис. 43) несколько напоминает работу агломерационной машины. В этом случае конвертируемый газ проходит сверху вниз через слой шихты.

Рис. 43. Схема процесса получения железа на движущейся колосниковой решётке: 1 – обжиговая конвейерная машина, 2 – шихта, 3 – зона сушки, 4 – зона обжига и восстановления, 5 – электропечь, 6 – ковш для жидкого металла, 7 – ковш для шлака
Существует разновидность процесса получения железа на движущейся колосниковой решетке, когда вместо конвертированного газа используют твердый восстановитель (каменный уголь, кокс и т.д.).
В этом случае сырые окатыши в головной части установки сушат рециркулируемыми газами, после чего окатыши поступают в зону обжига, где в результате просасывания горячих газов происходит нагрев и восстановление оксидов железа. Основным преимуществом этого процесса является возможность подавать в установку для восстановления неупрочненные обжигом окатыши. Недостатком этого процесса является загрязнение губчатого железа пустой породой, серой и фосфором твердого топлива.
Производство железа во вращающихся трубчатых печах
Другой разновидностью процесса с использованием твердого восстановителя является способ получения железа во вращающихся трубчатых печах (рис. 44).

Рис. 44. Схема установки с применением трубчатых вращающихся печей: 1 – элеватор; 2 – исходная шихта; 3 – вращающаяся печь; 4– вибропитатель; 5 – пылеуловитель; 6 – уборка пыли; 7 – зона горения топлива и плавления материалов; 8 – горелка
По этому способу во вращающуюся трубчатую печь, установленную под небольшим углом к горизонту, загружается шихта, состоящая из руды, твердого топлива и доломита или известняка. Доломит и известняк используются для десульфурации. Печь отапливается газообразным или жидким топливом при помощи горелок, установленных на разгрузочном конце печи.
По мере продвижения шихты от загрузочного конца печи к разгрузочному, навстречу газообразным продуктам горения, происходит восстановление оксидов железа. Восстановление протекает в основном через газовую фазу при участии твердого углерода. На разгрузочном конце печи восстановленный материал для предупреждения окисления охлаждается в специальном вращающемся охладителе и после дробления и последующего магнитного обогащения используется в сталеплавильном производстве.
Кричное железо
Кричное железо, которое получалось в результате сыродутного процесса, отличалось мягкостью, однако еще в древности был открыт способ получения более твердого металла. Для этого применялось сваривание, а также закалка железных изделий или их цементация.
Способ получения сварного железа, а также методы поверхностной закалки, по-видимому, были впервые применены в 1400 г. до н.э. в Армении, в небольшом местечке Шохдок-Карадаг, расположенном к северо-востоку от горы Арарат.
Здесь имелись богатые залежи железных руд, так называемых гематитов, а также запасы топлива в виде обширных лесных массивов. Жители этого района начали выплавлять железо, основываясь на опыте разработки и плавки медных руд.
Выплавляемое в Закавказье железо шло в Месопотамскую долину, в Шумерийское государство, в страны, расположенные в Передней Азии, а оттуда — и в Египет.
Несколько позже возникли и другие центры выделки железа. Стремление иметь более прочные орудия труда и оружие привело к открытию метода производства стали. Уже в античном мире начиная с первой половины I тысячелетия до н.э. сталь широко использовалась для изготовления орудий труда и оружия.
Греческие авторы в своих работах различают понятия железа, которое они называли «сидеро», и стали, которую они называли «халипс». Это название происходило от народа халипсов, жившего в то время на юго-восточном берегу Черного моря.
Производство железа в реакторах кипящего слоя
В основу этого способа положен эффект так называемого кипящего слоя, при котором создаются условия для хорошего контакта мелких железорудных материалов с газообразным восстановителем.
Сущность явления кипящего слоя заключается в следующем. Если через слой зернистого материала пропускать восходящий поток газа, то при небольших скоростях газа твердые частицы будут оставаться неподвижными. Слой будет выполнять роль фильтрующего пористого элемента.
Для создания кипящего слоя под горизонтальную решетку реактора, на которую загружают исходный железорудный материал, подается горячий восстановительный газ с определенной скоростью.
Чтобы предотвратить спекание восстановленного железа процесс ведется при низкой температуре (около 500 °С). Железо полученное при этой температуре, характеризуется повышенной пирофорностью (самовозгораемостью на воздухе). Для предотвращения пирофорности полученное железо нагревают до 820…880 °С с последующим охлаждением в восстановительной или нейтральной атмосфере.
Булат (сталь): откуда он появился и кто его использовал
Первые сведения о булате поступили 2300 лет тому назад от участников знаменитого похода Александра Македонского в Индию.
Воины рассказывали, что клинки индийцев рубят камни и рассекают в воздухе легкие ткани.
Возможно, именно эти сведения использовал в своем романе «Талисман» Вальтер Скотт.
Он описывает состязание в ловкости между султаном Саладином и английским королем Ричардом Львиное Сердце. Ричард своим стальным мечом разрубил на две части копье одного из рыцарей. В ответ Саладин подбросил в воздух покрывало из тончайшей ткани и рассек его своим булатным клинком.

Булат действительно впервые появился в Индии.
Индусы продавали в страны Востока вутцы — «хлебцы» из стали. Они представляли собою плоские лепешки диаметром 12,5 см и толщиной 0,25 см. Весили вутцы около 900 грамм. Такой «хлебец» разрубался пополам, на равные части, чтобы покупатель мог рассмотреть строение металла.
Искусством обработки стали индийские мастера владели в совершенстве.
«Никогда не будет народа, который лучше бы разбирался в отдельных видах мечей и в их названиях, чем жители Индии», — писал Бируни, увидевший воочию производство стали и мечей. Особенно поразили его цветные мечи. Отполированное железо индийцы натирали раскаленным порошком медного купороса, после чего получали мечи различных цветов — зеленые, синие, белые и с узорами.
Среди множества индийских мечей наиболее глубокое впечатление произвел на Бируни меч под названием «маджли», на котором были изображены животные и деревья. Стоимость его равнялась цене лучшего слона. Но если на мече изображались человеческие фигуры, такое оружие стоило еще дороже.
Узоры, рисунки на металле были главной отличительной особенностью булатных мечей.
Нa одних булатах узоры были видны невооруженным глазом сразу после полировки. На других они появлялись только после травления соком растений.
Узор мог быть крупным и мелким.
Другим местом, где производили отличные булаты, стал город Дамаск. В средние века из Дамаска мечи поступали в разные страны. Их можно было увидеть даже в африканских племенах. Булатная сталь позже стала называться дамасской.
Как удавалось людям средневековья создавать из нержавеющей стали, необычайно прочной, булатные клинки, было загадкой.
Разные ученые во многих странах пытались разгадать тайну булата. Знаменитый английский физик Михаил Фарадей пытался получить булат путем добавки к стали алюминия и платины.
В конце концов, тайна булатной стали была раскрыта уральским металлургом Павлом Аносовым. После долгих лет поисков, проб и ошибок, в 1837 году ему удалось изготовить в городе Златоусте булатный клинок. Аносову было известно, что в Москве в XVI-XVII веках еще существовало производство булатов.
Он был знаком с документами той поры, где встречались записи: «Сабельная полоса, булат синий, московский выков», «сабля полоса русская с долами на булатное дело». К концу XVII века искусство изготовления булата, пришло в упадок и постепенно забылось. И вот спустя двести с лишним лет в Златоусте появился булат. «Полоска булата сгибалась без малейшего повреждения, издавала чистый и высокий звон. Отполированный конец крошил лучшие английские зубила, тогда как отпущенный — легко принимал впечатления и отсекался чисто и ровно», — писал Аносов в «Горном журнале».
Уготовленный в Златоусте булатный клинок был золотистого отлива и с крупным сетчатым или коленчатым узором.
Знатоки считали, что такой узор — признак высшего сорта булата. Сделанный на Златоустовской фабрике клинок разрубал гвозди и кости, не повреждая лезвие. С помощью этих клинков можно было проделать тот же фокус с тонким газовым покрывалом, которым поразил Саладин короля Ричарда.
Люди так долго бились над загадкой булата, что были крайне удивлены, когда Аносов сообщил, что булатная сталь представляет собою «железо и углерод и ничего более; все дело в чистоте исходных материалов, в методе охлаждения, в кристаллизации».
Булат и в самом деле оказался высокоуглеродистой сталью без каких-либо особых примесей, являясь продуктом естественной кристаллизации стали, полученной при соединении железа и углерода.
Сущность образования булата заключалась в насыщении сплава большим количеством углерода (около 1,3-1,5%). При медленном охлаждении образовывалось и находилось в некотором излишке соединение железа с углеродом — так называемый цементит, который не растворялся, как бывает в обычной стали, а оставался в железе как бы во взвешенном состоянии. Прослойки цементита обволакивались медленно стынущим мягким железом.
Поэтому при высоком содержании углерода, придающим металлу твердость, булат сохраняет высокую гибкость, упругость, не свойственную обыкновенной стали. Из-за наличия прослоек хрупкого цементита ковка булата должна производиться крайне осторожно, ударами легкого молота, с многократным нагреванием до критической температуры, то есть, до температуры красного каления. Если ее поднять выше, булат потеряет свои основные свойства и свой характерный рисунок. Процесс изготовления булата отличается трудоемкостью, длительностью и требует высокого искусства.
Во время разработки процесса производства булата, Аносов попутно изобрел новый способ получения стали путем сплавления негодных к употреблению железных и стальных обсечков в глиняных горшках, то есть тиглях, при помощи высокой температуры воздушных печей.
Наладив на Урале производство тигельной стали, Аносов сообщил, что она ни в чем не уступает английской литой стали.
В наше время булатная сталь не производится. Дело в том, что она была продуктом ремесленного кустарного производства, и имела в общем-то единственное применение — для изготовления холодного оружия. Зато современная техника нашла много способов получения стали самых разнообразных марок с различными свойствами, которыми не обладала булатная сталь.
Современной технике нужны металлы и сплавы для работы при давлении в сотни и тысячи атмосфер и при глубоком вакууме, когда давление близко к нулю. Хладостойкие стали должны сохранять прочность при температурах, близких к абсолютному нулю (-273°С). Для атомных реакторов нужен металл с наибольшей магнитопроводимостью, для двигателей реактивных самолетов и ракет — сталь, способная сохранять прочность при очень высоких температурах и большой нагрузке.
Первое упоминание о стали уходит в далекие 8-12 века до нашей эры. Уже тогда войска индийского царя Пора имели оружие прочное и острое.
Индийским мастерам удалось получить высокоуглеродистую сталь, названую булатом. Изготовление ее было сложным и секрет производства остался нераскрытым.
Агрегаты FASTMET и ITmk3
В данных агрегатах осуществляется получение железа из руды и некосующегося угля. В агрегатах FASTMET также могут утилизироваться побочные продукты (пыли и шламы), содержащие железо, которые образуются на заводах с полным металлургическим циклом. Развитие этой технологии привело к созданию в 1996 г. процесса ITmk3 производства «передельного чугуна высшего качества» из окатышей или брикетов, схема процессов приведена на рис. 45.

Рис. 45. Схема процессов FASTMET, FAST MELT и ITmk3:1-бункера с компонентами шихты; 2 – окомкование; 3 – сушка; 4 – брикетирование; 5 – печь с вращающимся подом; 6 – компрессор; 7 – регенератор; 8 – воздух для горелки; 9 – топливо для горелки; 10 – газоочистка; 11 – дымовая труба; 12 – электросталеплавильная печь; 13 – сепаратор
Технология получения железа следующая. Из мелкой железной руды после ее смешивания с углем получают гранулы, которые высушивают и загружают в печь с вращающимся подом. Процесс по существу выполняется на большом поворотном столе, который вращается в пределах тороидального огражденного пространства.
Гранулы из шихты загружаются на вращающийся под печи одним или двумя слоями и во время вращения нагреваются горелками, расположенными над слоем, где также происходит дожигание оксида углерода и летучих угля, выделяющихся при нагреве и восстановлении оксидов. Один оборот вращающейся печи осуществляется за 10 мин.
В случае процесса FASTMET продукцией является губчатое железо, FASTMELT – жидкая сталь, а в процессе ITmk3 данные комки плавятся в последней зоне этого пода, тем самым получая гранулы чугуна и шлак. Конечным этапом является разделение чугунных комков и шлака.
История производства и использования железа
Сталь – это сплав железа с углеродом.
Благодаря углероду сталь становится твердой и прочной, вязкость и пластичность железа снижается.
Процент содержания углерода до 2,14.
В далекие времена люди находили металлы в природе. Сначала они были лишь украшением.
Затем появились медные наконечники для копий и стрел. Железо же было на вес золота до тех пор, пока человек не научился выплавлять его из руды в печах, положив начало железному веку.
Уже многими годами позже сумели выпускать нержавеющую сталь и металлопрокат, узнать о стоимости которого вы сможете перейдя по ссылке https://www.allmetal.ru/.
Еще древние металлурги заметили, что свойства металла зависят от состава и его обработки.
Тогда было замечено, если нагреть докрасна железо, а затем охладить в воде, то твердость металла повышалась.
Такая закалка и сейчас применяется в обработке стали. Тогда каждый мастер имел свой секрет закалки стали, но объяснения, почему металл становился прочнее, не было.
Древние алхимики пытались описать процесс металлургии в теории. В 13 веке н.э. алхимик Магнус внес свой вклад, сделав записи о превращении железа в сталь путем дистилляции водянистой части и закалке.
Он утверждал, что сталь становится белее за счет отделения примесей, а также отметил, что слишком крепкий металл в итоге рассыпается под молотом.
Ученые следующих веков продолжали искать разгадку происходящих в металле явлений.
В частности, в Германии была издана книга, где описывались свойства стали, делающие ее незаменимой для режущих инструментов и орудий. Замечено, что при разгорячении и медленном охлаждении сталь становилась мягкой. А при быстром охлаждении в жидкости металл становился крайне твердым и утрачивал хрупкость. Англичане долго хранили тайну закалки стали в расплавленном свинце или олове.
История получения стали – это история опытов над металлами, понимание трансформации железа.
Ученые долго разгадывали тайну превращения железа в прочный сплав. Многочисленные опыты давали то прочный, но хрупкий металл, то мягкий, гнущийся и быстро тупящийся. 10 лет понадобилось русскому ученому Аносову П.П. для обоснования производства прочной качественной стали. Путем проб и ошибок Аносов пытался раскрыть тайну булатной стали.
Продолжателем его идей стал Чернов Д.К., который описал превращение руды в сталь с научной точки зрения.
Он сумел отлить брусок высококачественной стали и изготовить из него булатные кинжалы, описал процесс в научном труде. Важным его открытием стало открытие критических точек стали.
Сейчас железную руду выплавляют в огромных доменных печах на металлургических заводах.
Руда превращается сначала в чугун. Затем он плавится в мартенах, превращаясь в сталь. За этим процессом наблюдают квалифицированные специалисты.
Источник https://chemege.ru/iron/
Источник https://xn--h1ajim.xn--p1ai/index.php/%D0%9F%D1%80%D1%8F%D0%BC%D0%BE%D0%B5_%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5_%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%B0
Источник https://miminonino.ru/stali/proizvodstvo-zheleza.html