Тяжелые металлы список всех
Тяжелые металлы и их соли (Си, Zn, Hg, Cd, Pb, Sn, Fe, Mn, Ag, Cr, Co, Ni, As, Al) — широко распространенные промышленные загрязнители. В водоемы они поступают из естественных источников (горных пород, поверхностных слоев почвы и подземных вод), со сточными водами многих промышленных предприятий и атмосферными осадками, которые загрязняются дымовыми выбросами. Тяжелые металлы как микроэлементы постоянно встречаются в естественных водоемах и органах гидробионтов (см.таблицу). В зависимости от геохимических условий отмечаются широкие колебания их уровня.
| Естественные уровни металлов в природных водах (по А. П. Виноградову, Я. М. Грушко и Д. Бокрис) | |||||
| Элемент | Содержание металлов (мкг/л) | Элемент | Содержание металлов(мкг/л) | ||
| в морской воде | в речной воде | в морской воде | в речной воде | ||
| Ртуть | 0,03 | 0,03 — 2,8 | Олово | 3,0 | 1,0 — 3,0 |
| Кадмий | 0,1 | 0,1 — 1,3 | Железо | 10,0 | 10,0 — 67,0 |
| Медь | 3,0 | 1.0 — 20,0 | Марганец | 2,0 | 1,0 — 50,0 |
| Цинк | 10,0 | 0,1 — 20,0 | Мышьяк | 10,0 | 30,0 — 64,0 |
| Кобальт | 0,5 | 0,1 — 1,0 | Алюминий | 10,0 | 1,0 — 50,0 |
| Хром | 0,02 | 1,0 — 10,0 | Никель | 2,0 | 0,8 — 5,6 |
| Свинец | 0,03 | 1,0 — 23,0 | Серебро | 0,04 | 0,1 |
Тяжелые металлы довольно устойчивы. Поступая в водоемы, они включаются в круговорот веществ и подвергаются различным превращениям. Неорганические соединения быстро связываются буферной системой воды и переходят в слаборастворимые гидроокиси, карбонаты, сульфиды и фосфаты, а также образуют металлорганические комплексы, адсорбируются донными осадками. Под воздействием живых организмов (микробов и др.) ртуть, олово, мышьяк подвергаются метилированию, превращаясь в более токсичные алкильные соединения. Кроме того, металлы способны накапливаться в различных организмах и передаваться в возрастающих количествах по трофической цепи. Особенно опасны ртуть, цинк, свинец, кадмий, мышьяк, так как они, поступая с пищей в организм человека и высших животных, могут вызвать отравления. Коэффициент материальной кумуляции колеблется у них от сотен до нескольких тысяч.
Считают, что большая часть неорганических соединений металлов поступает в организм рыб с пищей. Через жабры и кожу проникают растворимые диссоциирующие соли и металлорганические соединения. Антропогенные источники многократно (в 2 — 13 раз) повышают концентрацию тяжелых металлов в воде. С этим четко коррелирует содержание металлов в органах рыб.
Токсическое действие большинства тяжелых металлов на рыб обусловлено их ионами. Концентрированные растворы их солей, обладая вяжуще-прижигающим действием, нарушают функции органов дыхания. В слабых разведениях, проникая в организм, они нарушают проницаемость биологических мембран, снижают содержание растворимых протеинов, связываются с сульфгидрильными и аминогруппами белков и вызывают тем самым угнетение активности ферментов. Гидроокиси железа и марганца, осаждаясь на жабрах и икре, нарушают газообмен, что приводит к асфиксии. С повышенным загрязнением морской воды соединениями титана, железа, кадмия, хрома и других металлов связывают поражение рыб (треска, ершоватки и др.) опухолями (эпидермальная папиллома, псевдоопухоль жабр, карцинома печени) и язвенной болезнью, а также деформацию скелета и воспаление плавников.
В клинической симптоматике острых отравлений рыб тяжелыми металлами преобладают нервно-паралитический синдром и нарушение дыхания, которое обусловлено дистрофическими и некробиотическими изменениями в жабрах и коже. При хроническом отравлении симптомы выражены слабо. На первое место выступают деструктивные изменения жаберного аппарата и паренхиматозных органов, анемия и истощение рыб.
Болезни рыб: Справочник. — М. . Г. В. Васильков, Л. И. Грищенко, В. Г. Енгашев и др.; Под ред. В. С. Осетрова. . 1989 .
Полезное
Смотреть что такое «ТЯЖЕЛЫЕ МЕТАЛЛЫ» в других словарях:
ТЯЖЕЛЫЕ МЕТАЛЛЫ — ТЯЖЕЛЫЕ МЕТАЛЛЫ, металлы высокой плотности (с высокими АТОМНЫМИ НОМЕРАМИ). Применяются в электронных микроскопах для «мечения» биологических образцов, чтобы отслеживать детали их структуры. При попадании в почву тяжелые металлы становятся… … Научно-технический энциклопедический словарь
Тяжелые металлы — Тяжелые металлы: группа металлов с атомной массой более 50 (Pb, Cd, Ni, Cr, Zn, Cu, Hg), которые при определенных концентрациях могут оказывать токсичное действие. Источник: ГОСТ Р 17.4.3.07 2001. Охрана природы. Почвы. Требования к свойствам… … Официальная терминология
ТЯЖЕЛЫЕ МЕТАЛЛЫ — цветные металлы с плотностью, большей, чем у железа: Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg … Большой Энциклопедический словарь
тяжелые металлы — тяжелые металлы: Группа металлов с атомной массой более 50 (Pb, Cd, Ni, Cr, Zn, Cu, Hg), которые при определенных концентрациях могут оказывать токсичное действие. Источник: ГОСТ Р 17.4.3.07 2001: Охрана прир … Словарь-справочник терминов нормативно-технической документации
ТЯЖЕЛЫЕ МЕТАЛЛЫ — ТЯЖЁЛЫЕ МЕТАЛЛЫ металлы со сравнительно большой атомной массой (свинец, ртуть, цинк, стронций и др.). Включаясь в круговорот веществ и накапливаясь в природной среде, ведут к ее загрязнению и являются потенциально опасными (токсичными) для… … Экологический словарь
Тяжелые металлы — Heavy metal Тяжелые металлы. Вольфрамовые сплавы с никелем, медью и/или железом, с содержанием вольфрама минимум 90 % и плотностью минимум 16800 кг/м3. (Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО Профессионал , НПО … Словарь металлургических терминов
Тяжелые металлы — металлы с плотностью более 8000 кг/м3 (кроме благородных и редких). К тяжелым металлам относят Pb, Cu, Zn, Ni, Cd, Со, Sb, Sn, Bi, Hg … Энциклопедический словарь по металлургии
ТЯЖЕЛЫЕ МЕТАЛЛЫ — металлы с плотностью более 8000 кг/м3 (кроме благородных и редких). К тяжелым металлам относят Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg … Металлургический словарь
тяжелые металлы — [heavy metals] группа цветных металлов плотностью большей, чем у железа (7,86 г/см3), включающая Со, Ni, Cu, Zn, Nb, Mo, W и др.; Смотри также: Металлы щелочные металлы чистые металлы … Энциклопедический словарь по металлургии
Тяжёлые металлы
Тяжёлые мета́ллы — группа химических элементов со свойствами металлов (в том числе и полуметаллы) и значительным атомным весом либо плотностью. Известно около сорока различных определений термина тяжелые металлы, и невозможно указать на одно из них, как наиболее принятое. Соответственно, список тяжелых металлов согласно разным определениям будет включать разные элементы. Используемым критерием может быть атомный вес свыше 50, и тогда в список попадают все металлы, начиная с ванадия, независимо от плотности. Другим часто используемым критерием является плотность, примерно равная или большая плотности железа (8 г/см3), тогда в список попадают такие элементы как свинец, ртуть, медь, кадмий, кобальт, а, например, более легкое олово выпадает из списка. Существуют классификации, основанные и на других значениях пороговой плотности или атомного веса. Некоторые классификации делают исключения для благородных и редких металлов, не относя их к тяжелым, некоторые исключают нецветные металлы (железо, марганец).
Термин тяжелые металлы чаще всего рассматривается не с химической, а с медицинской и природоохранной точек зрения [1] и, таким, образом, при включении в эту категорию учитываются не только химические и физические свойства элемента, но и его биологическая активность и токсичность, а также объем использования в хозяйственной деятельности. [2]
Биологическая роль
Многие тяжелые металлы, такие как железо, медь, цинк, молибден, участвуют в биологических процессах и в определенных количествах являются необходимыми для функционирования растений, животных и человека микроэлементами. С другой стороны, тяжёлые металлы и их соединения могут оказывать вредное воздействие на организм человека, способны накапливаться в тканях, вызывая ряд заболеваний. Не имеющие полезной роли в биологических процессах металлы, такие как свинец и ртуть, определяются как токсичные металлы. Некоторые элементы, такие как ванадий или кадмий, обычно имеющие токсичное влияние на живые организмы, могут быть полезны для некоторых видов. [3]
Загрязнение тяжелыми металлами
Среди разнообразных загрязняющих веществ тяжёлые металлы (в том числе ртуть, свинец, кадмий, цинк, мышьяк) и их соединения выделяются распространенностью, высокой токсичностью, многие из них — также способностью к накоплению в живых организмах. Они широко применяются в различных промышленных производствах, поэтому, несмотря на очистительные мероприятия, содержание соединения тяжелых металлов в промышленных сточных водах довольно высокое. Они также поступают в окружающую среду с бытовыми стоками, с дымом и пылью промышленных предприятий. Многие металлы образуют стойкие органические соединения, хорошая растворимость этих комплексов способствует миграции тяжелых металлов в природных водах. К тяжелым металлам относят более 40 химических элементов, но при учете токсичности, стойкости, способности накапливаться во внешней среде и масштабов распространения токсичных соединений, контроля требуют значительно меньшее число элементов.
Загрязнение океана
Помимо сточных вод, большие массы соединений тяжелых металлов поступают в океан через атмосферу и с захоронением разнообразных отходов в Мировом океане. Для морских биоценозов наиболее опасны ртуть, свинец и кадмий.
Ртуть
Ртуть переносится в океан с материковым стоком (прежде всего — из стока промышленных вод) и через атмосферу. В составе атмосферной пыли содержится около 12 тыс.т. ртути. До трети от этого количества образуется при выветривании пород, содержащих ртуть (киноварь). Ртуть антропогенного происхождения попадает в атмосферу в первую очередь при сжигании угля на электростанциях. Около половины годового промышленного производства этого металла (910 тыс. тонн) попадает в океан. Некоторые бактерии переводят токсичные хлориды ртути в еще более токсичную метилртуть. [4] Соединения ртути накапливается многими морскими и пресноводными организмами в концентрациях, во много раз превышающих содержание ее в воде.
Употребление в пищу рыбы и морепродуктов неоднократно приводило к ртутному отравлению населения. Так, к 1977 году насчитывалось 2800 жертв болезни Минамата, причиной которой послужило поступление в залив Минамата со сточными водами отходов предприятий, на которых в качестве катализатора использовалась хлористая ртуть. Соединения ртути высокотоксичны для человека.
Свинец
Свинец — рассеянный элемент, содержащийся во всех компонентах окружающей среды: в горных породах, почвах, природных водах, атмосфере, живых организмах. Помимо того, свинец поступает в окружающую среду в результате хозяйственной деятельности человека, в том числе с выхлопными газами поступает используемый в топливе тетраэтилсвинец. Через атмосферу океан получает 20-30 тысяч тонн свинца в год с континентальной пылью. [4]
В организм человека свинец попадает как с пищей и водой, так и из воздуха. Свинец может выводиться из организма, однако малая скорость выведения может приводить к накоплению в костях, печени и почках.
Кадмий
Кадмий является относительно редким и рассеянным элементом, в природе концентрируется в минералах цинка. Поступает в природные воды в результате смыва почв, выветривания полиметаллических и медных руд, и со сточными водами рудообогатительных, металлургических и химических производств. Кадмий в норме присутствует в организме человека в микроскопических количествах. При накоплении организмом соединений кадмия поражается нервная система, нарушается фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Тяжелые металлы – перечень, свойства и риски элементов
Официально такой группы химических элементов не существует. Однако металлурги, аграрии, особенно экологи, оперируют понятием «тяжелые металлы». Этот сегмент привлекает повышенное внимание.

Что представляют собой
Термин «тяжелые металлы» еще двести лет назад пытался ввести в научный оборот немецкий химик Лео Гмелин.
Однако в номенклатуре Международного союза, курирующего вопросы теории и практики химии (IUPAC), такое подразделение отсутствует.
Промышленность
В академических и промышленных кругах циркулирует четыре десятка критериев, по которым металл признается тяжелым.
Самые популярные основания:
- Атомный номер выше 50.
- Плотность 5+ г/см3.
На практике чаще востребован второй критерий.
То есть к тяжелым металлам относятся элементы с плотностью, превышающей 5 г/см3.
В соответствии с ним таковыми считаются:
- Традиционные: железо, медь, хром, марганец, кобальт, олово, свинец, никель, цинк.
- Менее известные: кадмий, молибден, вольфрам, сурьма. Плюс экзотика – галлий, теллур.
- И самые коварные – ртуть, таллий, висмут.
На бытовом уровне они считаются токсичными элементами. Подобное отождествление некорректно.
Не каждый тяжелый металл токсичен, но таким способно стать при благоприятных условиях безобидное вещество.
Экология, медицина
У экологов и врачей свои подходы. Для них тяжелыми металлами являются особо значимые (полезные либо опасные) для биологических организмов элементы.
Суровее критерии Организации Объединенных наций (ООН). В соответствии с ее экологической доктриной, тяжелыми считаются стабильные металлы либо металлоиды, их соединения (особенно соли тяжелых металлов) с плотностью более 4,5 г/см3.
Критерий действует с 1998 года.
Классификация
Кроме плотности, маркером принадлежности к группе служат температура плавления, степень использования, другие свойства.
На основании этого выделяют следующие виды тяжелых металлов:
- – цинк, медь, олово, свинец, никель. – железо.
- Редкие – галлий, висмут, таллий, кадмий. – молибден, вольфрам, хром. – кадмий, кобальт, свинец, ртуть, олово, галлий, таллий, висмут.
Самый тяжелый металл планеты – иридий. Кубик с ребром в 1 см весит 22,6 грамма. Но вещество попадает на Землю только с метеоритами.

В сегменте обычных земных «тяжеловесов» лидирует вольфрам – он на три грамма легче. Это восьмая позиция среди металлов.
Откуда берутся
Естественных поставщиков тяжелых металлов четыре:
- Горное сырье. Чаще это магматические либо осадочные породы.
- Породообразующие минералы. У меди, например, это малахит и другие минералы.
- Вулканы. Частицы вещества извергаются попутно с вулканическими продуктами (газами, гейзерами).
Еще один источник – Вселенная. Вещество заносится в стратосферу метеоритами либо облаками космической пыли.
Получение продукта
На большинстве металлургических комбинатах сырье плавят в доменных и мартеновских печах. Это оборудование из позапрошлого века делает процесс тяжелым, опасным для экологии и человека.
Внедрение « зеленых » технологий продвигается медленно, поскольку требует инвестиций.
Результат недостаточной очистки отходов производства – высокое содержание вредных компонентов. Следствие – загрязнение почвы, воды, воздуха.
Влияние на экологию
Особо опасные загрязнители биосферы – именно тяжелые металлы. Самая вредная форма соединений – соли.
Пути поступления
Загрязнение биосферы происходит следующими способами:
- Металлургия. Выбросы в процессе плавки, обжига. Вымывание тяжелых веществ из отвалов месторождений либо меткомбинатов водой, выветривание.
- Агросектор. Полив плантаций, удобрение полей илом бытовых стоков либо пестицидами.
- Быт. Использование как топлива торфа, угля, другого сырья.
- Автобаны. Свинцом, цинком, кадмием насыщены обочины автострад.
Свинец пропитывает почву минимум на 100 м по обе стороны дороги.

Способы очищения
Почва очищается от такого груза десятилетиями, иногда столетиями.
Концентрация цинка уменьшается наполовину спустя столетие, кадмию требуется вдвое меньше.
Медь исчезает через три столетия, свинец – через десять:
- Токсичные соединения растворяются в воде.
- В почве процесс активируют влажность и растительность.
Флора вытягивает «свои» металлы. Так, лишайники «кушают» цинк, никель, медь.

Токсичность тяжелых металлов возрастает с увеличением атомного номера.
Воздействие на человека
Влияние большинства таких веществ двояко:
- Микродозы цинка, железа, меди задействованы в биологических процессах. Например, поддержании уровня гемоглобина в крови.
- Превышение микродоз опасно: тормозится работа нервной системы, сердца, почек, других органов. Разрушается скелет, идет разбалансировка жизненных процессов.
- Токсичны бесполезные свинец, ртуть.
Отравление организма внешне проявляется как тошнота, рвота, головная боль, нарушение координации движений. Плюс более тяжелые последствия, до летального исхода.
В зоне риска следующие категории:
- Работники меткомбинатов.
- Жители мегаполисов, окрестностей автострад.
- Потребители продуктов со стихийных рынков (не прошедших санитарный контроль).
Уровень загрязненности территории экологи определяют благодаря местным животным.
Чуткие «индикаторы» загрязненности на европейской части – лоси, мышь-полевка, кроты, бурый мишка.
Тяжелые металлы
Тяжёлые мета́ллы — согласно одному из определений, которых известно около сорока, это металлы с плотностью, большей »/>
, чем у железа, в частности, свинец, ртуть, медь, кадмий, кобальт, никель. [1]
Варианты определения
Тяжёлые металлы — это элементы периодической системы химических элементов Д. И. Менделеева, с относительной молекулярной массой больше 40.
Действие на живые организмы
Тяжёлые металлы оказывают вредное воздействие на организм человека, способны накапливаться в тканях, вызывая ряд заболеваний.
Примечания
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Тяжелые металлы» в других словарях:
ТЯЖЕЛЫЕ МЕТАЛЛЫ — и их соли (Си, Zn, Hg, Cd, Pb, Sn, Fe, Mn, Ag, Cr, Co, Ni, As, Al) широко распространенные промышленные загрязнители. В водоемы они поступают из естественных источников (горных пород, поверхностных слоев почвы и подземных вод), со сточными водами … Болезни рыб: Справочник
ТЯЖЕЛЫЕ МЕТАЛЛЫ — ТЯЖЕЛЫЕ МЕТАЛЛЫ, металлы высокой плотности (с высокими АТОМНЫМИ НОМЕРАМИ). Применяются в электронных микроскопах для «мечения» биологических образцов, чтобы отслеживать детали их структуры. При попадании в почву тяжелые металлы становятся… … Научно-технический энциклопедический словарь
Тяжелые металлы — Тяжелые металлы: группа металлов с атомной массой более 50 (Pb, Cd, Ni, Cr, Zn, Cu, Hg), которые при определенных концентрациях могут оказывать токсичное действие. Источник: ГОСТ Р 17.4.3.07 2001. Охрана природы. Почвы. Требования к свойствам… … Официальная терминология
ТЯЖЕЛЫЕ МЕТАЛЛЫ — цветные металлы с плотностью, большей, чем у железа: Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg … Большой Энциклопедический словарь
тяжелые металлы — тяжелые металлы: Группа металлов с атомной массой более 50 (Pb, Cd, Ni, Cr, Zn, Cu, Hg), которые при определенных концентрациях могут оказывать токсичное действие. Источник: ГОСТ Р 17.4.3.07 2001: Охрана прир … Словарь-справочник терминов нормативно-технической документации
ТЯЖЕЛЫЕ МЕТАЛЛЫ — ТЯЖЁЛЫЕ МЕТАЛЛЫ металлы со сравнительно большой атомной массой (свинец, ртуть, цинк, стронций и др.). Включаясь в круговорот веществ и накапливаясь в природной среде, ведут к ее загрязнению и являются потенциально опасными (токсичными) для… … Экологический словарь
Тяжелые металлы — Heavy metal Тяжелые металлы. Вольфрамовые сплавы с никелем, медью и/или железом, с содержанием вольфрама минимум 90 % и плотностью минимум 16800 кг/м3. (Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО Профессионал , НПО … Словарь металлургических терминов
Тяжелые металлы — металлы с плотностью более 8000 кг/м3 (кроме благородных и редких). К тяжелым металлам относят Pb, Cu, Zn, Ni, Cd, Со, Sb, Sn, Bi, Hg … Энциклопедический словарь по металлургии
ТЯЖЕЛЫЕ МЕТАЛЛЫ — металлы с плотностью более 8000 кг/м3 (кроме благородных и редких). К тяжелым металлам относят Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg … Металлургический словарь
тяжелые металлы — [heavy metals] группа цветных металлов плотностью большей, чем у железа (7,86 г/см3), включающая Со, Ni, Cu, Zn, Nb, Mo, W и др.; Смотри также: Металлы щелочные металлы чистые металлы … Энциклопедический словарь по металлургии
Список тяжелых металлов: виды и особенности

Из всех 104 известных человечеству на сегодня химических элементов 82 составляют металлы. Они занимают видное место в жизни людей в промышленной, биологической и экологической сфере. Современная наука подразделяет металлы на тяжёлые, лёгкие и благородные. В этой статье мы рассмотрим список тяжёлых металлов и их особенности.
Определение тяжёлых металлов
Изначально тяжёлыми металлами принято было называть тех их представителей, которые имеют атомную массу выше 50. Однако употребление названного термина на сегодняшний день происходит чаще не с химической точки зрения, а в зависимости от их воздействия на загрязнение окружающей среды. Таким образом, список тяжёлых металлов включает те металлы и металлоиды (полуметаллы), которые загрязняют элементы человеческой биосферы (почву, воду). Давайте рассмотрим их.
Сколько элементов включает список тяжёлых металлов?
На сегодня не существует единого мнения относительно количества элементов в названном перечне, поскольку нет общих критериев, относящих металлы к тяжёлым. Тем не менее, список тяжёлых металлов может быть сформирован в зависимости от различных свойств металлов и их признаков. К ним относят:
- Атомный вес. Исходя из этого критерия, к названным принадлежат более 40 элементов с атомной массой, превышающей 50 а.е.м (г/моль).
- Плотность. Исходя из этого критерия, тяжёлыми считаются те металлы, у которых плотность равна или превосходит плотность железа.
- Биологическая токсичность объединяет тяжёлые металлы, негативно влияющие на жизнедеятельность человека и живых организмов. В их списке порядка 20 элементов.
Влияние на организм человека
Большинство названных веществ оказывают негативное воздействие на все живые организмы. Ввиду значительной атомной массы, они плохо транспортируются и накапливаются в тканях человека, вызывая различные заболевания. Так, для человеческого организма кадмий, ртуть и свинец признаны как самые опасные и самые тяжёлые металлы.
Список токсичных элементов группируется по степени опасности по так называемым правилам Мертца, согласно которым наиболее токсичные металлы имеют наименьший диапазон экспозиции:
- Кадмий, ртуть, таллий, свинец, мышьяк (группа самых опасных металлических ядов, превышение допустимых норм которых способно привести к серьёзным психо-физиологическим нарушениям и даже к летальному исходу).
- Кобальт, хром, молибден, никель, сурьма, скандий, цинк.
- Барий, марганец, стронций, ванадий, вольфрам
Это однако не означает, что ни один из элементов, сгруппированных выше, по правилам Мертца, не должен присутствовать в человеческом организме. Напротив, список тяжёлых металлов насчитывает в нем эти и ещё более 20 элементов, небольшая концентрация которых не только не опасна для жизнедеятельности человека, но и необходима в метаболических процессах, особенно железо, медь, кобальт, молибден и даже цинк.
Загрязнение окружающей среды тяжёлыми металлами

Элементами биосферы, подвергающимся загрязнению тяжёлыми металлами, являются почва и вода. Чаще всего виновниками этого выступают металлургические предприятия, перерабатывающие лёгкие и тяжёлые цветные металлы. Список загрязняющих агентов также пополняют предприятия по сжиганию мусора, автомобильные выхлопы, котельные, химико-производственные, типографические компании и даже электростанции.
Чаще всего токсинами являются: свинец (автомобильное производство), ртуть (пример распространения: разбитые в быту градусники и люминесцентные осветительные приборы), кадмий (образуется в результате сжигания мусора). Кроме этого, большинство заводов в производстве используют тот или иной элемент, который может быть охарактеризован как тяжёлый. Металл группы, список которой был приведен выше, в виде отходов поступает чаще всего в водоёмы и далее по трофической цепи доходит до человека.
Кроме техногенных факторов загрязнения природы тяжёлыми металлами, существуют также природные – это извержения вулканов, в лаве которых обнаружено повышенное содержание кадмия.

Особенности распространения в природе самых токсичных металлов
Ртуть в природе более всего локализуется в водной и воздушной среде. В воды мирового океана ртуть поступает из промышленных сливов, также встречаются пары ртути, образующиеся вследствие горения угля. Токсичные соединения аккумулируются в живых организмах, особенно в морепродуктах.
Свинец имеет широкую область распространения. Он накапливается и в горах, и в почве, и в воде, и в живых организмах, и даже в воздухе, в виде выхлопных газов от автомобилей. Конечно, свинец поступает в окружающую среду и в результате антропологического действия в виде отходов от промышленной отрасли и неутилизированных отходов (аккумуляторы и батарейки).

А источником загрязнения окружающей среды кадмием являются сточные воды промышленных предприятий, а также природные факторы: выветривание медных руд, вымывание почв, а также результаты вулканической активности.
Область применения тяжёлых металлов
Несмотря на токсичность, современная промышленность создаёт огромное множество полезных продуктов, перерабатывая тяжёлые цветные металлы, список которых включает сплавы меди, цинка, свинца, олова, никеля, титана, циркония, молибдена и др.
Медь – высокопластичный материал, из которого получаются разнообразные провода, трубы, кухонная утварь, украшения, кровельное покрытие и многое другое. Кроме того, она широко используется в машиностроении и кораблестроительстве.

Цинк обладает высокими антикоррозийными свойствами, поэтому распространено использование цинковых сплавов для покрытия металлических изделий (т. н. оцинковка). Области применения продуктов из цинка: строительство, машиностроение, полиграфия (изготовление печатных форм), ракетостроение, химическая промышленность (производство лаков и красок) и даже медицина (антисептические средства и др.).

Свинец легко плавится, поэтому используется в качестве сырья во многих отраслях: лакокрасочной, химической, автомобильной (входит в состав аккумуляторов), радиоэлектронной, медицинской (изготовление защитных фартуков для пациентов во время прохождения рентген-исследований).
Читайте также:
- Подводная краска для металла
- Резка рулонного металла резка металла
- Металлический штакетник для забора в шахматном порядке
- Самодельные мини печки из металла
- Безынерционные катушки с металлическим корпусом
14 различных типов металлов

Термин «металл» происходит от греческого слова «metalléuō», что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы — это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы — это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин «железо» происходит от латинского слова «Ferrum», что переводится как «железо». Таким образом, термин «черный металл» обычно означает «содержащий железо», тогда как «цветной металл» означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы — это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель — для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро — второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов — использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
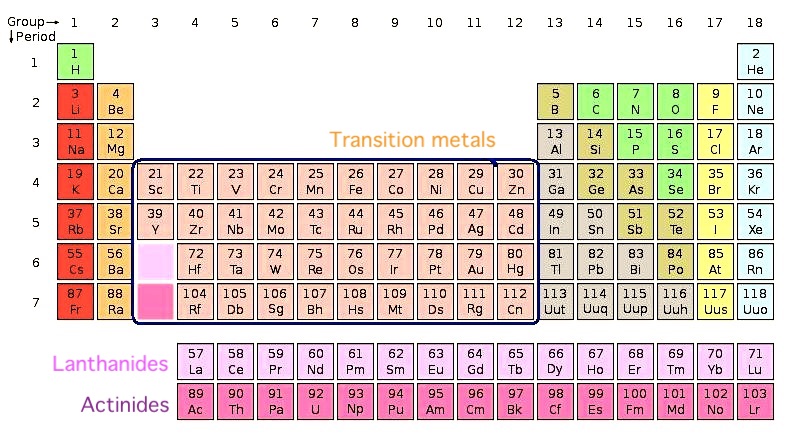
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице — это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются «бедными» или «другими» металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий — в топливных элементах и полупроводниках.
2. Лантаноиды

Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды — это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды — это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Тяжелые металлы — Heavy metals

Тяжелые металлы обычно определяются как металлы с относительно высоким плотности, атомные веса, или же атомные номера. Используемые критерии и металлоиды включены, различаются в зависимости от автора и контекста. [2] В металлургия например, тяжелый металл может быть определен на основе плотности, тогда как в физике критерием различия может быть атомный номер, в то время как химик, вероятно, будет больше интересоваться химическое поведение. Были опубликованы более конкретные определения, но ни одно из них не получило широкого признания. Определения, рассматриваемые в этой статье, охватывают до 96 из 118 известных химические элементы; Только Меркурий, вести и висмут встретить их всех. Несмотря на это отсутствие согласия, термин (множественное или единственное число) широко используется в науке. Плотность более 5 г / см 3 иногда цитируется как часто используемый критерий и используется в основной части этой статьи.
Самые ранние известные металлы — обычные металлы, такие как утюг, медь, и банка, и драгоценные металлы, такие как серебро, золото, и платина — тяжелые металлы. С 1809 г. легкие металлы, Такие как магний, алюминий, и титан, были обнаружены, а также менее известные тяжелые металлы, включая галлий, таллий, и гафний.
Некоторые тяжелые металлы являются незаменимыми питательными веществами (обычно железо, кобальт, и цинк ) или относительно безвредны (например, рутений, серебро и индий ), но может быть токсичным в больших количествах или в определенных формах. Другие тяжелые металлы, такие как кадмий, ртуть и свинец очень ядовиты. Возможные источники отравления тяжелыми металлами включают: добыча полезных ископаемых, хвосты, промышленные отходы, сельскохозяйственные стоки, профессиональное облучение, краски и обработанная древесина.
К физическим и химическим характеристикам тяжелых металлов следует относиться с осторожностью, поскольку соответствующие металлы не всегда определяются последовательно. Помимо того, что тяжелые металлы относительно плотны, они, как правило, менее реактивный чем более легкие металлы и имеют гораздо меньше растворимый сульфиды и гидроксиды. Хотя относительно легко отличить тяжелый металл, такой как вольфрам из более легкого металла, такого как натрий, некоторые тяжелые металлы, такие как цинк, ртуть и свинец, обладают некоторыми характеристиками более легких металлов, а более легкие металлы, такие как бериллий, скандий, и титан обладают некоторыми характеристиками более тяжелых металлов.
Тяжелые металлы относительно редки в земной коры но присутствуют во многих аспектах современной жизни. Они используются, например, в гольф-клубы, легковые автомобили, антисептики, самоочищающиеся печи, пластмассы, солнечные панели, мобильные телефоны, и ускорители частиц.
- 1 Определения
- 1.1 Список тяжелых металлов по плотности
- 2.1 Критика
- 2.2 Популярность
- 4.1 Экологические тяжелые металлы
- 4.2 Важные в питании тяжелые металлы
- 4.3 Другие тяжелые металлы
- 4.4 Источники воздействия
- 7.1 В зависимости от веса или плотности
- 7.2 На основе прочности или долговечности
- 7.3 Биологические и химические
- 7.4 Расцветка и оптика
- 7.5 Электроника, магниты и освещение
- 7.6 Ядерная
- 9.1 Цитаты
- 9.2 Рекомендации
Определения
Список тяжелых металлов по плотности
Стратегический (30)
Считается жизненно важным для нескольких наций ‘
стратегические интересы [58] Эти 30 включают 22 перечисленных здесь и
8 ниже (6 драгоценных и 2 товарных).- Сурьма†
- Церий
- Диспрозий
- Эрбий
- Европий
- Гадолиний
- Галлий
- Германий†
- Гольмий
- Индий
- Лантан
- Лютеций
- Неодим
- Ниобий
- Празеодим
- Самарий
- Тантал
- Тербий
- Тулий
- Вольфрам
- Уран
- Иттербий
Драгоценный (8)
Редко и дорого [59]
Торгуется тонна на LME
Незначительное (14)
Ни стратегический, ни драгоценный, ни товарный- Мышьяк†
- Висмут
- Кадмий
- Гафний
- Марганец
- Меркурий
- Протактиний
- Рений
- Селен†
- Теллур†
- Таллий
- Торий
- Ванадий
- Цирконий
Долговечный (15)
Период полураспада более 1 дня- Актиний ¶
- Америций
- Берклиум
- Калифорний
- Кюрий
- Дубний
- Эйнштейний
- Фермий
- Менделевий
- Нептуний ¶
- Плутоний ¶
- Полоний ¶
- Прометий ¶
- Радий ¶
- Технеций ¶
Эфемерный (16)
Период полураспада менее 1 дня- Астатин ‡ ¶
- Бориум
- Копернициум
- Дармштадтиум
- Флеровий
- Калий
- Лоуренсий
- Ливерморий
- Мейтнерий
- Московиум
- Nihonium
- Нобелий
- Рентгений
- Резерфордий
- Сиборгий
- Tennessine
Происхождение и использование термина
Тяжесть встречающиеся в природе металлы Такие как золото, медь, и утюг мог быть замечен в предыстория и в свете их пластичность, привели к первым попыткам изготовления металлических украшений, инструментов и оружия. [64] Все металлы, открытые с тех пор до 1809 года, имели относительно высокую плотность; их тяжесть считалась исключительно отличительным критерием. [65]
С 1809 г. легкие металлы, такие как натрий, калий и стронций были изолированы. Их низкая плотность противоречит общепринятым представлениям, и было предложено называть их металлоиды (что означает «напоминающие металлы по форме или внешнему виду»). [66] Это предложение было проигнорировано; новые элементы стали называть металлами, а затем термин «металлоид» использовался для обозначения неметаллических элементов, а позднее элементов, которые было трудно описать как металлы или неметаллы. [67]
Термин «тяжелый металл» впервые был использован в 1817 году, когда немецкий химик Леопольд Гмелин разделил элементы на неметаллы, легкие металлы и тяжелые металлы. [68] Легкие металлы имели плотность 0,860–5,0 г / см3. 3 ; тяжелые металлы 5.308–22.000. [69] [n 10] Позднее этот термин стал ассоциироваться с элементами с высоким атомным весом или высоким атомным номером. [19] Иногда он используется как синонимы термина тяжелый элемент. Например, обсуждая историю ядерная химия, Маги [70] отмечает, что когда-то считалось, что актиниды представляют новую группу переходных тяжелых элементов, тогда как Сиборг и коллеги «предпочитали . тяжелый металл редкоземельный как сериал . ». астрономия Однако тяжелый элемент — это любой элемент тяжелее, чем водород и гелий. [71]
Критика
В 2002 году шотландский токсиколог Джон Даффус проанализировал определения, использованные за предыдущие 60 лет, и пришел к выводу, что они настолько разнообразны, что фактически лишают этот термин смысла. [72] Наряду с этим открытием, статус тяжелых металлов для некоторых металлов иногда ставится под сомнение на том основании, что они слишком легкие, или участвуют в биологических процессах, или редко представляют опасность для окружающей среды. Примеры включают скандий (слишком легкий); [19] [73] ванадий к цинк (биологические процессы); [74] и родий, индий, и осмий (слишком редко). [75]
Популярность
Несмотря на сомнительное значение, термин тяжелый металл регулярно появляется в научной литературе. Исследование 2010 года показало, что он все чаще используется и, похоже, стал частью языка науки. [76] Считается, что это приемлемый термин, учитывая его удобство и известность, если он сопровождается строгим определением. [41] Аналоги тяжелых металлов, легкие металлы, упоминаются Общество минералов, металлов и материалов как включая «алюминий, магний, бериллий, титан, литий, и другие химически активные металлы ». [77] Названные металлы имеют плотность от 0,534 до 4,54 г / см. 3 .
Биологическая роль
Количество тяжелых металлов в
в среднем 70 кг человеческого телаЭлемент Миллиграммы [78] Утюг 4000 4000 Смотрите также: Существенный элемент
Следы некоторых тяжелых металлов, в основном в период 4, необходимы для определенных биологических процессов. Это утюг и медь (кислород и электронный транспорт ); кобальт (сложные синтезы и клеточный метаболизм ); цинк (гидроксилирование ); [83] ванадий и марганец (регуляция ферментов или функционирующий); хром (глюкоза утилизация); никель (рост клеток ); мышьяк (метаболический рост у некоторых животных и, возможно, у людей) и селен (антиоксидант функционирование и гормон производство). [84] Периоды 5 и 6 содержат меньше основных тяжелых металлов, что согласуется с общей закономерностью, согласно которой более тяжелые элементы, как правило, менее распространены, а более дефицитные элементы с меньшей вероятностью являются необходимыми с точки зрения питания. [85] В период 5, молибден требуется для катализ из редокс реакции; кадмий используется некоторыми морскими диатомеи с той же целью; и банка может потребоваться для роста у некоторых видов. [86] В период 6, вольфрам требуется некоторыми археи и бактерии для метаболические процессы. [87] Дефицит любого из этих 4-6 основных тяжелых металлов может повысить восприимчивость к отравление тяжелыми металлами [88] (наоборот, избыток также может иметь неблагоприятные биологические эффекты ). В среднем 70 кг тело человека составляет около 0,01% тяжелых металлов (~ 7 г, что эквивалентно весу двух сушеных горохов, с железом — 4 г, цинком — 2,5 г и свинцом — 0,12 г, включая три основных компонента), 2% легких металлов (~ 1,4 кг, вес бутылки вина) и почти 98% неметаллов (в основном воды ). [89] [n 15]
Было обнаружено, что некоторые несущественные тяжелые металлы обладают биологическим действием. Галлий, германий (металлоид), индий и большинство лантаноидов могут стимулировать метаболизм, а титан способствует росту растений [90] (хотя это не всегда считается тяжелым металлом).
Токсичность
Основное внимание в этом разделе уделяется более серьезным токсическим эффектам тяжелых металлов, включая рак, повреждение мозга и смерть, а не вреду, который они могут нанести одной или нескольким участкам кожи, легких, желудка, почек, печени или сердца. Для получения более подробной информации см. Токсичность металлов, Токсичный тяжелый металл, или статьи об отдельных элементах или соединениях.
Часто считается, что тяжелые металлы очень токсичны или вредны для окружающей среды. [91] Некоторые из них токсичны, в то время как другие токсичны, только если их принимать в избытке или встречаться в определенных формах.
Экологические тяжелые металлы
Хром, мышьяк, кадмий, ртуть и свинец обладают наибольшим потенциалом причинения вреда из-за их широкого использования. токсичность некоторых из их комбинированных или элементарных форм, а также их широкое распространение в окружающей среде. [92] Шестивалентный хром, например, очень токсичен, как и пары ртути и многие соединения ртути. [93] Эти пять элементов имеют сильное сродство с серой; в человеческом теле они обычно связываются через тиол группы (–SH), чтобы ферменты отвечает за контроль скорости метаболических реакций. Образовавшиеся связи сера-металл препятствуют правильному функционированию задействованных ферментов; здоровье человека ухудшается, иногда со смертельным исходом. [94] Хром (в его шестивалентной форме) и мышьяк являются канцерогены; кадмий вызывает дегенеративная болезнь костей; а ртуть и свинец повреждают Центральная нервная система.

Хром кристаллы
и 1 см 3 куб
Мышьяк, запечатанный в
контейнер, чтобы предотвратить потускнение
Кадмий бар
и 1 см 3 куб
Меркурий существование
вылили в чашка Петри
Окисленный вести
узелки и 1 см 3 кубСвинец является наиболее распространенным загрязнителем тяжелых металлов. [95] Уровни в водной среде индустриальных обществ, по оценкам, в два-три раза выше, чем доиндустриальные уровни. [96] В составе тетраэтилсвинец, (CH
3 CH
2 )
4 Pb , он широко использовался в бензин в течение 1930–1970-х гг. [97] Хотя к 1996 году использование этилированного бензина в Северной Америке было в значительной степени прекращено, в почвах рядом с дорогами, построенными до этого времени, сохраняется высокая концентрация свинца. [98] Более поздние исследования продемонстрировали статистически значимую корреляцию между уровнем использования этилированного бензина и насильственными преступлениями в Соединенных Штатах; с учетом отставания во времени в 22 года (для среднего возраста жестоких преступников) кривая насильственных преступлений практически повторяет кривую воздействия свинца. [99]Другие тяжелые металлы, известные своей потенциально опасной природой, обычно как токсичные загрязнители окружающей среды, включают марганец (поражение центральной нервной системы); [100] кобальт и никель (канцерогены); [101] медь, [102] цинк [103] селен [104] и серебро [105] (эндокринный нарушение врожденные нарушения или общие токсические эффекты для рыб, растений, птиц или других водных организмов); жесть, как оловоорганическое вещество (поражение центральной нервной системы); [106] сурьма (подозреваемый канцероген); [107] и таллий (поражение центральной нервной системы). [102] [n 16] [n 17]
Важные в питании тяжелые металлы
Тяжелые металлы, необходимые для жизни, могут быть токсичными, если их принимать в избытке; некоторые имеют особенно токсичные формы. Пятиокись ванадия (V2О5) является канцерогенным для животных и при вдыхании вызывает ДНК повреждать. [102] Фиолетовый перманганат ион MnO –
4 это печень и почка яд. [111] Употребление более 0,5 г железа может вызвать сердечную недостаточность; такие передозировки чаще всего возникают у детей и могут привести к смерти в течение 24 часов. [102] Карбонил никеля (Ni (CO)4), в количестве 30 частей на миллион, может вызвать дыхательную недостаточность, повреждение мозга и смерть. [102] Выпив грамм или более сульфат меди (CuSO4) может быть фатальным; выжившие могут остаться с серьезным повреждением органов. [112] Более пяти миллиграммов селена очень токсичны; это примерно в десять раз превышает рекомендуемую максимальную суточную дозу в 0,45 миллиграмма; [113] длительное отравление может иметь паралитические эффекты. [102] [n 18]Другие тяжелые металлы
Некоторые другие несущественные тяжелые металлы имеют одну или несколько токсичных форм. Почечная недостаточность и летальные исходы были зарегистрированы в результате приема диетических добавок германия (всего от 15 до 300 г, потребляемых в течение периода от двух месяцев до трех лет). [102] Воздействие на четырехокись осмия (OsO4) может вызвать необратимое повреждение глаз и привести к дыхательной недостаточности [115] и смерть. [116] Соли индия токсичны при проглатывании более нескольких миллиграммов и влияют на почки, печень и сердце. [117] Цисплатин (PtCl2(NH3)2), который является важным лекарством, используемым для убить раковые клетки, также является ядом почек и нервов. [102] Висмут соединения могут вызвать повреждение печени при приеме в избытке; нерастворимые соединения урана, а также опасные радиация они выделяют, могут вызвать необратимое повреждение почек. [118]
Источники воздействия
Тяжелые металлы могут ухудшать качество воздуха, воды и почвы и впоследствии вызывать проблемы со здоровьем у растений, животных и людей, когда они становятся концентрированными в результате промышленной деятельности. [119] Общие источники тяжелых металлов в этом контексте включают горнодобывающие и промышленные отходы; выбросы транспортных средств; свинцово-кислотные батареи; удобрения; краски; и обработанная древесина; [120] стареющая инфраструктура водоснабжения; [121] и микропластик плавающие в Мировом океане. [122] Недавние примеры загрязнения тяжелыми металлами и рисков для здоровья включают возникновение Болезнь Минамата в Японии (1932–1968; судебные процессы продолжаются с 2016 года); [123] то Катастрофа на плотине Бенту-Родригес в Бразилии, [124] и высокий уровень свинца в питьевой воде, поставляемой жителям Флинт, Штат Мичиган, на северо-востоке США. [125]
Формирование, численность, появление и добыча
Смотрите также: Нуклеосинтез и Изобилие химических элементов
Наиболее обильные ( 56 300 частей на миллион по весу)
Редко (0,01–0,99 частей на миллион)
Обильный (100– 999 частей на миллион)
Очень редко (0,0001–0,0099 частей на миллион)
Нечасто (1–99 частей на миллион)Свойства по сравнению с легкими металлами
Некоторые общие физико-химические свойства легких и тяжелых металлов сведены в таблицу. К сравнению следует относиться с осторожностью, поскольку термины «легкий металл» и «тяжелый металл» не всегда имеют однозначное определение. Также физические свойства твердости и прочности на разрыв могут широко варьироваться в зависимости от чистоты, размером с зернышко и предварительная обработка. [157]
Свойства легких и тяжелых металлов
Физические свойства Легкие металлы Тяжелые металлы Плотность Обычно ниже Обычно выше Твердость [158] Мягкие, легко режутся или сгибаются Большинство довольно сложно Тепловое расширение [159] В основном выше В основном ниже Температура плавления В основном низкий [160] От низкого до очень высокого [161] Предел прочности [162] В основном ниже В основном выше Химические свойства Легкие металлы Тяжелые металлы Периодическая таблица место расположения Наиболее часто встречается в группах 1 и 2 [163] Почти все найдено в группах 3 через 16 Изобилие в земной коре [126] [164] Более обильный Менее обильный Основное появление (или источник) Литофилы [128] Литофилы или халькофилы (Au это сидерофил ) Реактивность [77] [164] Более реактивный Менее реактивный Сульфиды От растворимого до нерастворимого [n 25] Чрезвычайно нерастворим [169] Гидроксиды От растворимого до нерастворимого [n 26] Обычно нерастворим [173] Соли [166] В основном образуют бесцветные растворы в воде. В основном образуют цветные растворы в воде. Комплексы В основном бесцветный [174] В основном цветные [175] Биологическая роль [176] Включают макроэлементы (Na, Mg, K, Ca ) Включают микроэлементы (V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Пн ) Эти свойства позволяют относительно легко отличить легкий металл, такой как натрий, от тяжелого металла, такого как вольфрам, но различия становятся менее четкими на границах. Легкие структурные металлы, такие как бериллий, скандий и титан, обладают некоторыми характеристиками тяжелых металлов, например более высокими температурами плавления; [n 27] постпереходные тяжелые металлы, такие как цинк, кадмий и свинец, обладают некоторыми характеристиками легких металлов, такими как относительно мягкость, более низкие температуры плавления, [n 28] и образуя преимущественно бесцветные комплексы. [21] [23] [24]
Использует
Тяжелые металлы присутствуют практически во всех аспектах современной жизни. Железо может быть наиболее распространенным, поскольку на него приходится 90% всех очищенных металлов. Платина может быть наиболее распространенной, поскольку считается, что она содержится в 20% всех потребительских товаров или используется для ее производства. [181] Некоторые распространенные виды использования тяжелых металлов зависят от общих характеристик металлов, таких как электрическая проводимость и отражательная способность или общие характеристики тяжелых металлов, такие как плотность, прочность и долговечность. Другое использование зависит от характеристик конкретного элемента, например, от их биологической роли в качестве питательных веществ или ядов или некоторых других конкретных атомных свойств. Примеры таких атомарных свойств включают: частично заполненный d- или же f-орбитали (во многих переходных, лантаноидных и актинидных тяжелых металлах), которые делают возможным образование окрашенных соединений; [182] емкость большинства ионов тяжелых металлов (таких как платина, [183] церий [184] или висмут [185] ) существовать в разных состояния окисления и поэтому действуют как катализаторы; [186] плохо перекрывающиеся 3d или 4f орбитали (в железе, кобальте и никеле или тяжелых металлах лантаноидов из европий через тулий ), вызывающие магнитные эффекты; [187] и высокие атомные номера и электронные плотности которые лежат в основе их приложений в ядерной науке. [188] Типичные виды использования тяжелых металлов можно в общих чертах разделить на следующие шесть категорий. [189] [n 29]
В зависимости от веса или плотности

В виолончель (пример показан выше) или альт C-нить иногда включает вольфрам; его высокая плотность позволяет использовать струну меньшего диаметра и улучшает отзывчивость. [190]
Некоторые виды использования тяжелых металлов, в том числе в спорте, машиностроение, боеприпасы, и ядерная наука, воспользуйтесь их относительно высокой плотностью. В подводное плавание, свинец используется как балласт; [191] в скачки для инвалидов каждая лошадь должна иметь определенный вес свинца, основанный на факторах, включая прошлые выступления, чтобы уравнять шансы различных участников. [192] В гольф, вольфрам, латунь, или медные вставки в фарватер дубинки и утюги понизить центр тяжести клюшки, чтобы мяч легче поднялся в воздух; [193] Мячи для гольфа с вольфрамовым сердечником обладают лучшими летными характеристиками. [194] В нахлыст, тонущие шнуры имеют ПВХ покрытие залито порошком вольфрама, так что они тонут с необходимой скоростью. [195] В легкая атлетика спорт стали шары, используемые в метание молота и толкание ядра события заполняются свинцом для достижения минимального веса, требуемого международными правилами. [196] Вольфрам использовался в шарах для метания молотов по крайней мере до 1980 г .; минимальный размер шара был увеличен в 1981 году, чтобы исключить необходимость в том, что в то время было дорогим металлом (в три раза дороже других молотов), доступным не во всех странах. [197] Вольфрамовые молоты были настолько плотными, что слишком глубоко проникали в дерн. [198] В машиностроении тяжелые металлы используются для балласта лодок, [199] самолеты [200] и автотранспортные средства; [201] или в балансиры на колесах и коленчатые валы, [202] гироскопы, и пропеллеры, [203] и центробежные муфты, [204] в ситуациях, требующих максимального веса в минимальном пространстве (например, в смотреть движения ). [200]
Чем выше плотность снаряда, тем эффективнее он пробивает тяжелый броневой лист . Операционные системы, Ir, Pt, и Re . дорогие . U предлагает привлекательное сочетание высокой плотности, разумной стоимости и высокой вязкости разрушения.
А. М. Рассел и К. Л. Ли
Отношения структура – собственность
в цветных металлах (2005, стр.16)В военных боеприпасах вольфрам или уран используются в броня [205] и бронебойные снаряды, [206] а также в ядерное оружие для повышения эффективности (путем отражающие нейтроны и на мгновение задерживая расширение реагирующих материалов). [207] В 1970-е годы тантал оказался более эффективным, чем медь, в кумулятивный заряд и взрывоопасное противотанковое оружие из-за его более высокой плотности, что обеспечивает большую концентрацию усилий и лучшую деформируемость. [208] Меньше-токсичные тяжелые металлы, такие как медь, олово, вольфрам и висмут, и, вероятно, марганец (а также бор, металлоид), заменили свинец и сурьму в зеленые пули используется некоторыми армиями и в некоторых боеприпасах для развлекательной стрельбы. [209] Высказывались сомнения в безопасности (или зеленые полномочия ) вольфрама. [210] Поскольку более плотные материалы поглощают больше радиоактивных выбросов, чем более легкие, тяжелые металлы полезны для радиационная защита и чтобы фокусировать пучки излучения в линейные ускорители и лучевая терапия Приложения. [211]
На основе прочности или долговечности

В Статуя Свободы. А нержавеющая сталь сплав [212] арматура обеспечивает прочность конструкции; а медь кожа придает устойчивость к коррозии. [n 30]
Прочность или долговечность тяжелых металлов, таких как хром, железо, никель, медь, цинк, молибден, олово, вольфрам и свинец, а также их сплавов, делает их полезными для изготовления артефактов, таких как инструменты, оборудование, [214] бытовая техника, [215] посуда, [216] трубы [215] железнодорожные пути, [217] здания [218] и мосты, [219] автомобили, [215] замки, [220] мебель, [221] корабли [199] самолеты [222] чеканка [223] и ювелирные изделия. [224] Они также используются в качестве легирующих добавок для улучшения свойств других металлов. [n 31] Из двух десятков элементов, которые использовались в монетизированной мировой чеканке монет, только два, углерод и алюминий, не являются тяжелыми металлами. [226] [n 32] Золото, серебро и платина используются в ювелирных изделиях. [n 33] как (например) никель, медь, индий и кобальт в цветное золото. [229] Недорогие украшения и детские игрушки в значительной степени могут состоять из тяжелых металлов, таких как хром, никель, кадмий или свинец. [230] Медь, цинк, олово и свинец механически более слабые, но полезные коррозия профилактические свойства. Пока каждый из них будет реагировать с воздухом, в результате патины либо различных солей меди, [231] карбонат цинка, оксид олова, или смесь оксид свинца, карбонат, и сульфат, дарят ценные защитные свойства. [232] Поэтому медь и свинец используются, например, в качестве кровельные материалы; [233] [n 34] цинк действует как антикоррозийный агент в оцинкованная сталь; [234] и олово служит той же цели на стальные банки. [235] Технологичность и коррозионная стойкость железа и хрома повышаются за счет добавления гадолиний; то сопротивление ползучести никеля улучшается с добавлением тория. В медь добавляют теллур (Теллур Медь ) и стальных сплавов для улучшения их обрабатываемости; и сделать его более твердым и кислотостойким. [236]
Биологические и химические

Оксид церия (IV) (образец показан выше) используется как катализатор в самоочищающиеся печи. [237]
В биоцидный эффекты некоторые тяжелые металлы известны с глубокой древности. [238] Платина, осмий, медь, рутений и другие тяжелые металлы, включая мышьяк, используются в противораковых препаратах или показали потенциал. [239] Сурьма (антипротозойная), висмут (противоязвенный ), золото (антиартритический ) и железо (противомалярийный ) также важны в медицине. [240] Медь, цинк, серебро, золото или ртуть используются в антисептик составы; [241] небольшие количества некоторых тяжелых металлов используются для контроля роста водорослей, например, в градирни. [242] В зависимости от их предполагаемого использования в качестве удобрений или биоцидов, агрохимикаты может содержать тяжелые металлы, такие как хром, кобальт, никель, медь, цинк, мышьяк, кадмий, ртуть или свинец. [243] Отдельные тяжелые металлы используются в качестве катализаторов при переработке топлива (например, рений), синтетическая резина и производство волокна (висмут), устройства контроля выбросов (палладий), а в самоочищающиеся печи (куда оксид церия (IV) в стенках таких духовок помогает окислять углерод остатки готовки). [244] В химии мыла тяжелые металлы образуют нерастворимое мыло, которое используется в консистентные смазки, сушилки для краски и фунгициды (кроме лития, щелочных металлов и аммоний растворимые мыла в ионной форме). [245]
Расцветка и оптика
Сульфат неодима (Nd2(ТАК4)3), используется для окраски посуды [246]
Цвета стекло, керамические глазури, краски, пигменты, и пластмассы обычно производятся путем включения тяжелых металлов (или их соединений), таких как хром, марганец, кобальт, медь, цинк, селен, цирконий, молибден, серебро, олово, празеодим, неодим, эрбий, вольфрам, иридий, золото, свинец или уран. [247] Татуировка чернила могут содержать тяжелые металлы, такие как хром, кобальт, никель и медь. [248] Высокая отражательная способность некоторых тяжелых металлов важна при строительстве зеркала, включая точность астрономические инструменты. Отражатели фар основаны на превосходной отражательной способности тонкой пленки родия. [249]
Электроника, магниты и освещение

В Топаз солнечная ферма в южной Калифорнии насчитывает девять миллионов кадмиево-теллуровые фотоэлектрические модули площадью 25,6 квадратных километров (9,5 квадратных миль).
Тяжелые металлы или их соединения можно найти в электронные компоненты, электроды, и проводка и солнечные панели где они могут использоваться как проводники, полупроводники или изоляторы. Молибденовый порошок используется в печатная плата чернила. [250] Оксид рутения (IV) титан с покрытием аноды используются для промышленного производства хлор. [251] Домашние электрические системы по большей части имеют медный провод из-за его хороших проводящих свойств. [252] Серебро и золото используются в электрических и электронных устройствах, особенно при контакте. переключатели в результате их высокой электропроводности и способности противостоять или минимизировать образование загрязнений на своей поверхности. [253] Полупроводники теллурид кадмия и арсенид галлия используются для изготовления солнечных батарей. Оксид гафния, изолятор, используется как регулятор напряжения в микрочипы; оксид тантала, другой изолятор, используется в конденсаторы в мобильные телефоны. [254] Тяжелые металлы используются в аккумуляторах более 200 лет, по крайней мере, с тех пор, как Вольта изобрел медь и серебро гальваническая свая в 1800 г. [255] Прометий, лантан, и ртуть — другие примеры, найденные соответственно в атомный, никель-металлогидрид, и кнопочная ячейка батареи. [256] Магниты изготовлены из тяжелых металлов, таких как марганец, железо, кобальт, никель, ниобий, висмут, празеодим, неодим, гадолиний и диспрозий. Неодимовые магниты — самый сильный тип постоянный магнит в продаже. Они являются ключевыми компонентами, например, дверных замков автомобилей, стартеры, топливные насосы, и электрические стеклоподъемники. [257] Тяжелые металлы используются в освещение, лазеры, и светодиоды (Светодиоды). Плоские дисплеи включать тонкую пленку электропроводящего оксид индия и олова. Флуоресцентное освещение в своей работе полагается на пары ртути. Рубиновые лазеры генерировать темно-красные лучи, возбуждая атомы хрома; лантаноиды также широко используются в лазерах. Галлий, индий и мышьяк; [258] а медь, иридий и платина используются в светодиодах (последние три в органические светодиоды ). [259]
Ядерная

An Рентгеновская трубка с вращающимся анодом, обычно вольфрам -рений сплав на молибден ядро, подкрепленное графит [260] [n 35]
Нишевые применения тяжелых металлов с высокими атомными номерами встречаются в диагностическая визуализация, электронная микроскопия, и ядерная наука. В диагностической визуализации тяжелые металлы, такие как кобальт или вольфрам, составляют анодные материалы, обнаруженные в рентгеновские трубки. [263] В электронной микроскопии тяжелые металлы, такие как свинец, золото, палладий, платина или уран, используются для создания проводящих покрытий и для введения электронной плотности в биологические образцы путем окрашивание, отрицательное окрашивание, или же вакуумное напыление. [264] В ядерной науке ядра тяжелых металлов, таких как хром, железо или цинк, иногда стреляют по другим мишеням из тяжелых металлов для получения сверхтяжелые элементы; [265] тяжелые металлы также используются как раскол цели по производству нейтроны [266] или же радиоизотопы такие как астат (используя в последнем случае свинец, висмут, торий или уран). [267]
Примечания
- ^ Использованные критерии были плотность:[3] (1) более 3,5 г / см 3 ; (2) более 7 г / см 3 ; атомный вес: (3) > 22.98; [3] (4)> 40 (без учета s- и f-блок металлы); [4] (5) > 200; [5]атомный номер: (6) > 20; (7) 21–92; [6]химическое поведение: (8) Фармакопея США; [7][8][9] (9) Определение на основе периодической таблицы Хокса (исключая лантаноиды и актиниды ); [10] и (10) биохимические классификации Нибора и Ричардсона. [11] Плотность элементов в основном из Эмсли. [12] Прогнозируемые плотности были использованы для В, Пт и FM –Ц. [13] Ориентировочные плотности получены для FM, Мкр, Нет и Lr исходя из их атомного веса, по оценкам металлические радиусы, [14] и предсказал плотно упакованный кристаллические структуры. [15] Атомные веса взяты из Эмсли, [12] внутренняя задняя крышка
- ^ Металлоиды, однако, были исключены из определения Хокса, основанного на периодической таблице, поскольку он отметил, что «нет необходимости решать, следует ли включать полуметаллы [то есть металлоиды] в качестве тяжелых металлов». [10]
- ^ Тест не специфичен для каких-либо конкретных металлов, но считается, что он способен, по крайней мере, обнаруживать Пн, Cu, Ag, CD, Hg, Sn, Pb, В качестве, Sb, и Би. [8] В любом случае, когда тест использует сероводород как реагент он не может обнаружить Чт, Ti, Zr, Nb, Та, или же Cr. [9]
- ^ Переходные и постпереходные металлы, которые обычно не образуют окрашенных комплексов, являются Sc и Y в группа 3; [21]Ag в группа 11; [22]Zn и CD в группе 12; [21][23] и металлы групп 13 –16. [24]
- ^ Сульфиды и гидроксиды лантаноидов (Ln) нерастворимы; [25] последний может быть получен из водных растворов солей Ln в виде окрашенных гелеобразных осадков; [26] и комплексы Ln имеют почти такой же цвет, что и их акваионы (большинство из которых окрашены). [27] Актинид (An) сульфиды могут быть или не быть нерастворимыми, в зависимости от автора. Двухвалентный моносульфид урана не подвергается воздействию кипящей воды. [28] Ионы трехвалентного актинида ведут себя аналогично ионам трехвалентного лантаноида, поэтому рассматриваемые сульфиды могут быть нерастворимыми, но это явно не указано. [29] Тервалентные сульфиды разлагаются [30] но Эдельштейн и др. говорят, что они растворимы [31] тогда как Хейнс говорит сульфид тория (IV) нерастворим. [32] В начале истории ядерного деления было отмечено, что осадки с сероводород был «удивительно» эффективным способом изолировать и обнаруживать трансурановые элементы в растворе. [33] В том же духе Дешлаг пишет, что элементы после урана должны были иметь нерастворимые сульфиды по аналогии с переходными металлами третьего ряда. Но он отмечает, что элементы после актиний было обнаружено, что они обладают свойствами, отличными от свойств переходных металлов, и утверждают, что они не образуют нерастворимых сульфидов. [34] Однако гидроксиды An нерастворимы. [31] и могут осаждаться из водных растворов их солей. [35] Наконец, многие комплексы An имеют «глубокие и яркие» цвета. [36]
- ^ Более тяжелые элементы обычно менее признаны как металлоиды —Ge; В качестве, Sb; Se, Te, По; В — удовлетворяют некоторым из трех частей определения Хокса. Все они содержат нерастворимые сульфиды. [35][37] но только Ge, Te и Po, по-видимому, имеют эффективно нерастворимые гидроксиды. [38] Все бары Ат могут быть получены в виде окрашенных (сульфидных) осадков из водных растворов их солей; [35] астатин также осаждается из раствора сероводородом, но, поскольку видимые количества At никогда не синтезировались, цвет осадка неизвестен. [37][39] В качестве p-блочные элементы, их комплексы обычно бесцветны. [40]
- ^ Терминология классов A и B аналогична терминологии «твердая кислота» и «мягкое основание» терминология, иногда используемая для обозначения поведения ионов металлов в неорганических системах. [42]
- ^ Бе и Ал — исключения из этой общей тенденции. У них несколько более высокие значения электроотрицательности. [43] Их ионы +2 или +3, будучи относительно небольшими, имеют высокую плотность заряда, тем самым поляризуя соседние электронные облака. В конечном итоге соединения Be и Al имеют значительный ковалентный характер. [44]
- ^Google ученый[46]
- ^ Если бы Гмелин работал с имперская система весов и мер, которые он мог выбрать, 300 фунтов / фут 3 в качестве отсечки для легких / тяжелых металлов, в этом случае селен (плотность 300,27 фунта / фут 3 ) составила бы оценку, тогда как 5 г / см 3 = 312,14 фунт / фут 3 .
- ^ Свинец, который является кумулятивный яд, имеет относительно высокую численность из-за его обширного исторического использования и антропогенного сброса в окружающую среду. [79]
- ^ Хейнс показывает количество [80]
- ^ Айенгар записал цифру 5 мг никеля; [81] Хейнс показывает количество 10 мг [80]
- ^ Включает 45 тяжелых металлов в количестве менее 10 мг каждый, включая As (7 мг), Mo (5), Co (1,5) и Cr (1,4). [82]
- ^ Из элементов, обычно называемых металлоидами, B и Si считались неметаллами; Ge, As, Sb и Te как тяжелые металлы.
- ^ Ni, Cu, Zn, Se, Ag и Sb фигурируют в правительственных ведомостях США. Список токсичных загрязнителей;[108] Mn, Co и Sn внесены в списки правительства Австралии. Национальный кадастр загрязнителей.[109]
- ^ Другим таким токсичным тяжелым металлом может быть вольфрам. [110]
- ^ Селен является наиболее токсичным из тяжелых металлов, необходимых для млекопитающих. [114]
- ^ Микроэлементы с содержанием, равным или намного меньшим одной части на триллион (а именно Tc, Вечера, По, В, Ра, Ac, Па, Np, и Пу ) не показаны. Изобилие из Лиде [126] и Эмсли; [127] типы событий взяты из McQueen. [128]
- ^ В некоторых случаях, например при наличии гамма-лучи высоких энергий или в среда, богатая водородом при очень высоких температурах, рассматриваемые ядра могут испытывать потерю нейтронов или усиление протонов, что приводит к образованию (сравнительно редко) нейтронно-дефицитные изотопы. [133]
- ^ Выброс вещества при столкновении двух нейтронных звезд объясняется взаимодействием их приливные силы, возможное разрушение корки и шоковый нагрев (что происходит, если вы нажимаете педаль акселератора в автомобиле, когда двигатель холодный). [136]
- ^ Железо, кобальт, никель, германий и олово также являются сидерофилами с точки зрения всей Земли. [128]
- ^ Считается, что тепло, выходящее из внутреннего твердого сердечника, вызывает движение во внешнем сердечнике, который сделан из сплавов жидкого железа. Движение этой жидкости генерирует электрические токи, которые вызывают магнитное поле. [147]
- ^ Тяжелые металлы, которые встречаются в природе в количествах, слишком малых для экономичной добычи (Tc, Pm, Po, At, Ac, Np и Pu), вместо этого производятся искусственная трансмутация. [149] Последний метод также используется для производства тяжелых металлов, начиная с америция. [150]
- ^ Сульфиды металлов 1 и 2 групп и алюминия гидролизуются водой; [165] скандий, [166] иттрий [167] и сульфиды титана [168] нерастворимы.
- ^ Например, гидроксиды калий, рубидий, и цезий имеют растворимость более 100 граммов на 100 граммов воды [170] тогда как из алюминия (0,0001) [171] и скандий ( [172] считаются нерастворимыми.
- ^ Бериллий имеет так называемую «высокую» температуру плавления 1560 К; скандий и титан плавятся при 1814 и 1941 К. [177]
- ^ Цинк — мягкий металл с Твердость Мооса 2,5; [178] кадмий и свинец имеют более низкие значения твердости — 2,0 и 1,5. [179] Цинк имеет «низкую» температуру плавления 693 К; кадмий и свинец плавятся при 595 и 601 К. [180]
- ^ К схеме сортировки были применены некоторая жестокость и абстракция деталей, чтобы сохранить количество категорий на управляемом уровне.
- ^ Кожа во многом позеленела за счет образования защитного патина состоит из антлерит Cu3(ОЙ)4ТАК4, атакамит Cu4(ОЙ)6Cl2, брошантит Cu4(ОЙ)6ТАК4, закись меди Cu2O и тенорит CuO. [213]
- ^ Для лантаноидов это единственное структурное применение, поскольку в остальном они слишком реактивны, относительно дороги и в лучшем случае умеренно сильны. [225]
- ^ Welter [227] классифицирует чеканка металлов в качестве драгоценные металлы (например, серебро, золото, платина); тяжелые металлы очень высокой прочности (никель); тяжелые металлы с низкой прочностью (медь, железо, цинк, олово, свинец); и легкие металлы (алюминий).
- ^ Эмсли [228] оценивает глобальные потери в шесть тонн золота в год из-за медленного износа 18-каратных обручальных колец.
- ^ Листовой свинец, подвергающийся суровому воздействию промышленного и прибрежного климата, прослужит столетия. [191]
- ^ Электроны, ударяясь о вольфрамовый анод, генерируют рентгеновские лучи; [261] рений обеспечивает лучшую стойкость вольфрама к тепловым ударам; [262] молибден и графит действуют как поглотители тепла. Плотность молибдена почти вдвое меньше плотности вольфрама, что снижает вес анода. [260]
Источники
Цитаты
- ^Эмсли 2011, pp. 288; 374
- ^ Пурре, Оливье (август 2018 г.). «О необходимости запрета термина« тяжелый металл »в научной литературе» (PDF) . Устойчивость. 10 (8): 2879. Дои:10.3390 / su10082879.
- ^ абcdеДаффус 2002, п. 798
- ^ абРэнд, Уэллс и Маккарти, 1995, п. 23
- ^ абБолдуин и Маршалл, 1999 г., п. 267
- ^ абЛиман 2003, п. 452
- ^ абФармакопея США 1985 г., п. 1189
- ^ абРагурам, Сома Раджу и Шрирамулу 2010, п. 15
- ^ абТорн и Робертс 1943, п. 534
- ^ абcdХоукс 1997
- ^ абНибор и Ричардсон 1980, п. 4
- ^ абЭмсли 2011
- ^Хоффман, Ли и Першина 2011, pp. 1691, 1723; Бончев и Каменская 1981, п. 1182
- ^Сильва 2010, стр. 1628, 1635, 1639, 1644
- ^Фурнье 1976, п. 243
- ^ абcВернон 2013, п. 1703
- ^Моррис 1992, п. 1001
- ^Горбачев, Замятнин и Лбов 1980, п. 5
- ^ абcДаффус 2002, п. 797
- ^Залог 2010, п. 1415
- ^ абcЛонго 1974, п. 683
- ^Томасик и Ратаевич 1985, п. 433
- ^ абHerron 2000, п. 511
- ^ абНатанс 1963, п. 265
- ^Топп 1965, п. 106: Schweitzer & Pesterfield 2010, п. 284
- ^Король 1995, п. 297; Меллор 1924, п. 628
- ^Хлопок 2006, стр.66
- ^Альбут и Делл 1963, п. 1796 г.
- ^Wiberg 2001, стр. 1722–1723
- ^Wiberg 2001, п. 1724
- ^ абЭдельштейн и др. 2010 г., п. 1796 г.
- ^Хейнс 2015, стр. 4–95
- ^Weart 1983, п. 94
- ^Deschlag 2011, п. 226
- ^ абcВульфсберг 2000, стр. 209–211
- ^Арланд, Лильензин и Ридберг 1973, п. 478
- ^ абКоренман 1959, п. 1368
- ^Ян, Джолли и О’Киф 1977, п. 2980; Wiberg 2001, pp. 592; Колтхофф и Эльвинг, 1964 г., п. 529
- ^Закрыть 2015, п. 78
- ^Приход 1977 г., п. 89
- ^ абРадуга 1991, п. 416
- ^Нибор и Ричардсон 1980, стр. 6–7
- ^Ли 1996, pp. 332; 364
- ^Клагстон и Флемминг 2000, pp. 294; 334, 336
- ^Нибур и Ричардсон 1980, п. 7
- ^Нибур и Ричардсон 1980
- ^Хюбнер, Астин и Герберт 2010, стр. 1511–1512
- ^Яруп 2003, п. 168; Расич-Милутинович и Йованович 2013, п. 6; Виджаявардена, Мегарадж и Найду, 2016 г., п. 176
- ^Даффус 2002, стр. 794–795; 800
- ^Эмсли 2011, п. 480
- ^USEPA 1988, п. 1; Уден 2005, стр. 347–348; DeZuane 1997, п. 93; Dev 2008, стр. 2–3
- ^ абIkehata et al. 2015 г., п. 143
- ^Эмсли 2011, п. 71
- ^Эмсли 2011, п. 30
- ^ абПодсики 2008, п. 1
- ^Эмсли 2011, п. 106
- ^Эмсли 2011, п. 62
- ^Чахмурадян, Смит и Киники, 2015 г., стр. 456–457
- ^Хлопок 1997, п. ix; Райан 2012, п. 369
- ^Герман, Хоффманн и Эшкрофт, 2013 г., п. 11604-1
- ^Эмсли 2011, п. 75
- ^Гриббон 2016, п. Икс
- ^Эмсли 2011, стр. 428–429; 414; Wiberg 2001, pp. 527; Эмсли 2011, pp. 437; 21–22; 346–347; 408–409
- ^Раймонд 1984, стр. 8–9
- ^Палаты 1743: «То, что отличает металлы от всех других тел . это их тяжесть . «
- ^Оксфордский словарь английского языка 1989; Горд и Хедрик 2003, п. 753
- ^Ювелир 1982, п. 526
- ^Хабаши 2009, п. 31 год
- ^Гмелин 1849, п. 2
- ^Маги 1969, п. 14
- ^Ридпат 2012, п. 208
- ^Даффус 2002, п. 794
- ^Липер 1978, п. ix
- ^Housecroft 2008, п. 802
- ^Шоу, Саху и Мишра 1999, п. 89; Мартин и Кутри 1982, стр. 2–3
- ^Хюбнер, Астин и Герберт 2010, п. 1513
- ^ абОбщество минералов, металлов и материалов 2016
- ^Эмсли 2011, стр. 35; пассим
- ^Эмсли 2011, стр. 280, 286; Бэрд и Канн 2012, стр. 549, 551
- ^ абХейнс 2015, стр. 7–48
- ^Айенгар 1998, п. 553
- ^Эмсли 2011, стр. 47; 331; 138; 133; пассим
- ^Нибур и Ричардсон 1978, п. 2
- ^Эмсли 2011, стр. 604; 31; 133; 358; 47; 475
- ^Валкович 1990, стр.214, 218
- ^Эмсли 2011, pp. 331; 89; 552
- ^Эмсли 2011, п. 571
- ^Венугопал и Лаки 1978, п. 307
- ^Эмсли 2011, стр. 24; пассим
- ^Эмсли 2011, стр. 192; 197; 240; 120, 166, 188, 224, 269, 299, 423, 464, 549, 614; 559
- ^Даффус 2002, pp. 794; 799
- ^Бэрд и Канн 2012, п. 519
- ^Козин и Хансен 2013, п. 80
- ^Бэрд и Канн 2012, стр. 519–520; 567; Rusyniak et al. 2010 г., п. 387
- ^Ди Майо 2001, п. 208
- ^Перри и Вандеркляйн 1996, п. 208
- ^Любовь 1998, п. 208
- ^Хендриксон 2016, п. 42
- ^Рейес 2007, стр. 1, 20, 35–36
- ^Эмсли 2011, п. 311
- ^Wiberg 2001, стр. 1474, 1501
- ^ абcdежграммчасТокар и др. 2013
- ^Эйслер 1993, стр. 3, пасс.
- ^Лемли 1997, п. 259; Олендорф 2003, п. 490
- ^Государственное управление водных ресурсов 1987 г., п. 63
- ^Скотт 1989, стр. 107–108
- ^Международная ассоциация сурьмы 2016
- ^Правительство США, 2014 г.
- ^Правительство Австралии, 2016 г.
- ^Агентство по охране окружающей среды США, 2014 г.
- ^Онг, Тан и Чунг 1997, п. 44
- ^Эмсли 2011, п. 146
- ^Эмсли 2011, п. 476
- ^Селинджер 1978, п. 369
- ^Коул и Стюарт 2000, п. 315
- ^Клегг 2014
- ^Эмсли 2011, п. 240
- ^Эмсли 2011, п. 595
- ^Станкович и Станкович 2013, стр. 154–159
- ^Брэдл 2005, стр. 15, 17–20
- ^Харви, Хэндли и Тейлор 2015, п. 12276
- ^Howell et al. 2012 г.; Cole et al. 2011 г., стр. 2589–2590
- ^Amasawa et al. 2016 г., стр. 95–101
- ^Массарани 2015
- ^Торрис 2016
- ^ абcЛиде 2004, стр. 14–17
- ^Эмсли 2011, pp. 29; пассим
- ^ абcМаккуин 2009, п. 74
- ^ абКокс 1997, стр. 73–89
- ^Кокс 1997, стр.32, 63, 85
- ^Подосек 2011, п. 482
- ^Падманабхан 2001, п. 234
- ^Rehder 2010, стр.32, 33
- ^Хофманн 2002, стр. 23–24
- ^Хадхази 2016
- ^Чоптуик, Ленер и Преториас 2015, п. 383
- ^Кокс 1997, стр. 83, 91, 102–103
- ^Берри и Мейсон 1959, стр. 210–211; Ранкин 2011, п. 69
- ^Хартманн 2005, п. 197
- ^Юсиф 2007, стр. 11–12
- ^Берри и Мейсон 1959, стр.214
- ^Юсиф 2007, стр.11
- ^Wiberg 2001, п. 1511
- ^Эмсли 2011, п. 403
- ^Литасов, Шацкий 2016, п. 27
- ^Сандерс 2003; Preuss 2011
- ^Природные ресурсы Канады 2015
- ^Маккей, Маккей и Хендерсон, 2002 г., стр. 203–204
- ^Эмсли 2011, стр. 525–528; 428–429; 414; 57–58; 22; 346–347; 408–409; Келлер, Вольф и Шани 2012, п. 98
- ^Эмсли 2011, стр. 32 и след.
- ^Эмсли 2011, стр.437
- ^Чен и Хуанг 2006, п. 208; Crundwell et al. 2011 г., стр. 411–413; Renner et al. 2012 г., п. 332; Сеймур и О’Фаррелли 2012, стр. 10–12
- ^Crundwell et al. 2011 г., п. 409
- ^Международная ассоциация металлов платиновой группы без даты, стр. 3–4
- ^Маклемор 2008, п. 44
- ^Wiberg 2001, п. 1277
- ^Рассел и Ли 2005, п. 437
- ^Маккарди 1992, п. 186
- ^фон Зерледер 1949, п. 68
- ^Чавла и Чавла 2013, п. 55
- ^фон Глайх 2006, п. 3
- ^Биддл и Буш 1949, п. 180
- ^Мэджилл 1992, п. 1380
- ^ абГиддинг 1973, стр. 335–336
- ^Wiberg 2001, п. 520
- ^ абSchweitzer & Pesterfield 2010, п. 230
- ^Macintyre 1994, п. 334
- ^Будка 1957, п. 85; Хейнс 2015, стр. 4–96
- ^Schweitzer & Pesterfield 2010, п. 230. Авторы, однако, отмечают, что «сульфиды . Ga (III) и Cr (III) имеют тенденцию растворяться и / или разлагаться в воде».
- ^Сиджвик 1950, п. 96
- ^Ондрейчка, Кортус и Гинтер, 1971 г., п. 294
- ^Гшнайднер 1975, п. 195
- ^Хасан 1996, п. 251
- ^Брэди и Холум 1995, п. 825
- ^Хлопок 2006, pp. 66; Арланд, Лильензин и Ридберг 1973, п. 478
- ^Нибор и Ричардсон 1980, п. 10
- ^Рассел и Ли 2005, стр.158, 434, 180
- ^Швейцер 2003, п. 603
- ^Самсонов 1968, п. 432
- ^Рассел и Ли 2005, стр. 338–339; 338; 411
- ^Эмсли 2011, pp. 260; 401
- ^Джонс 2001, п. 3
- ^Береа, Родригес-Ибело и Наварро, 2016 г., п. 203
- ^Алвес, Берутти и Санчес 2012, п. 94
- ^Ядав, Энтони и Субба Редди 2012, п. 231
- ^Мастера 1981, п. 5
- ^Вульфсберг 1987, стр. 200–201
- ^Брайсон и Хаммонд 2005, п. 120 (высокая электронная плотность); Фроммер и Стабулас-Сэвидж 2014, стр. 69–70 (высокий атомный номер)
- ^Лэндис, Софилд и Ю, 2011 г., п. 269
- ^Прието 2011, п. 10; Пикеринг 1991, стр. 5–6, 17
- ^ абЭмсли 2011, п. 286
- ^Бергер и Брюнинг, 1979 г., п. 173
- ^Джексон и Саммит 2006, стр.10, 13
- ^Шедд 2002, п. 80,5; Кантра 2001, п. 10
- ^Сполек 2007, п. 239
- ^Белый 2010, п. 139
- ^Дапена и Тевес 1982, п. 78
- ^Burkett 2010, п. 80
- ^ абМур и Рамамурти 1984, п. 102
- ^ абНациональный консультативный совет по материалам 1973, п. 58
- ^Ливси 2012, п. 57
- ^ВанГельдер 2014, стр. 354, 801
- ^Национальный консультативный совет по материалам 1971 г., стр. 35–37
- ^Фрик 2000, п. 342
- ^Rockhoff 2012, п. 314
- ^Рассел и Ли 2005, стр.16, 96
- ^Морштейн 2005, п. 129
- ^Рассел и Ли 2005, стр. 218–219
- ^Lach et al. 2015 г.; Di Maio 2016, п. 154
- ^Прешель 2005; Guandalini et al. 2011 г., п. 488
- ^Scoullos et al. 2001 г., п. 315; Ариэль, Барта и Брэндон 1973, п. 126
- ^Вингерсон 1986, п. 35 год
- ^Мати и Бабоян 1986, п. 299; Ливингстон 1991, стр.1401, 1407
- ^Кейси 1993, п. 156
- ^ абcБрэдл 2005, п. 25
- ^Кумар, Шривастава и Шривастава 1994, п. 259
- ^Нзержановски и Гавронски 2012, п. 42
- ^Пачеко-Торгал, Джалали и Фучич 2012, стр. 283–294; 297–333
- ^Venner et al. 2004 г., п. 124
- ^Технические публикации 1958 г., п. 235: «Вот прочный резак из твердого металла . для прорезания . замков, стальных решеток и других тяжелых металлов».
- ^Наджа и Волески 2009, п. 41 год
- ^Департамент ВМФ 2009 г., стр. 3.3–13
- ^Ребхандл и др. 2007 г., п. 1729 г.
- ^Гринберг и Паттерсон, 2008 г., п. 239
- ^Рассел и Ли 2005, стр.437, 441
- ^Роу и Роу 1992
- ^Welter 1976, п. 4
- ^Эмсли 2011, п. 208
- ^Эмсли 2011, п. 206
- ^Гуней и Загуры 2012, п. 1238; Cui et al. 2015 г., п. 77
- ^Brephol & McCreight 2001, п. 15
- ^Рассел и Ли 2005, стр. 337, 404, 411
- ^Эмсли 2011, pp. 141; 286
- ^Эмсли 2011, стр.625
- ^Эмсли 2011, стр. 555, 557
- ^Эмсли 2011, п. 531
- ^Эмсли 2011, п. 123
- ^Вебер и Рутула 2001, п. 415
- ^Данн 2009; Bonetti et al. 2009 г., стр.1, 84, 201
- ^Desoize 2004, п. 1529
- ^Атлас 1986, п. 359; Lima et al. 2013, п. 1
- ^Волесский 1990, п. 174
- ^Накбанпоте, Месунгноен и прасад 2016, п. 180
- ^Эмсли 2011, pp. 447; 74; 384; 123
- ^Эллиот 1946, п. 11; Варт 1956, п. 571
- ^МакКольм 1994, п. 215
- ^Эмсли 2011, pp. 135; 313; 141; 495; 626; 479; 630; 334; 495; 556; 424; 339; 169; 571; 252; 205; 286; 599
- ^Everts 2016
- ^Эмсли 2011, п. 450
- ^Эмсли 2011, п. 334
- ^Эмсли 2011, п. 459
- ^Мозель 2004, стр. 409–410
- ^Рассел и Ли 2005, п. 323
- ^Эмсли 2011, п. 212
- ^Третьков 2006
- ^Эмсли 2011, pp. 428; 276; 326–327
- ^Эмсли 2011, стр.73; 141; 141; 141; 355; 73; 424; 340; 189; 189
- ^Эмсли 2011, стр. 192; 242; 194
- ^Баранов 2015, п. 80; Wong et al. 2015 г., п. 6535
- ^ абБолл, Мур и Тернер, 2008 г., п. 177
- ^Болл, Мур и Тернер, 2008 г., стр. 248–249, 255
- ^Рассел и Ли 2005, п. 238
- ^Тиса 2001, п. 73
- ^Чендлер и Роберсон 2009, стр. 47, 367–369, 373; Исмаил, Хулбе и Мацуура 2015, п. 302
- ^Эббинг и Гаммон 2017, п. 695
- ^Пан & Дай 2015, п. 69
- ^Коричневый 1987, п. 48
Рекомендации
- Арланд С., Лильензин Дж. О. и Ридберг Дж. 1973, «Химия раствора», в J. C. Bailar & А. Ф. Тротман-Дикенсон (ред.), Комплексная неорганическая химия, т. 5, Актиниды, Pergamon Press, Оксфорд.
- Альбутт М. и Делл Р. 1963 г., Нитриты и сульфиды урана, тория и плутония: обзор современных знаний, Исследовательская группа Управления по атомной энергии Великобритании, Harwell, Беркшир.
- Алвес А. К., Берутти, Ф. А. и Санче, Ф. А. Л. 2012, «Наноматериалы и катализ», в К. П. Бергманн и М. Дж. Де Андраде (реклама), Наноструктурированные материалы для инженерных приложений, Springer-Verlag, Берлин,
- ISBN 978-3-642-19130-5.
- Амасава Э., Йи Теа Х., Ю Тинг Кхью, Дж., Икеда И. и Онуки М., 2016 г., «Извлечение уроков из инцидента Минамата для широкой общественности: Упражнения по устойчивости, блок Минамата AY2014», М. Эстебан , Т. Акияма, К. Чен, И. Икеа, Т. Мино (ред.), Наука об устойчивом развитии: полевые методы и упражнения, Springer International, Швейцария, стр. 93–116, Дои:10.1007/978-3-319-32930-7_5
- ISBN 978-3-319-32929-1.
- Ариэль Э., Барта Дж. И Брэндон Д. 1973, «Получение и свойства тяжелых металлов», Международная порошковая металлургия, т. 5, вып. 3. С. 126–129.
- Атлас Р. М. 1986, Основы и практическая микробиология, Издательская компания Macmillan, Нью-Йорк,
- ISBN 978-0-02-304350-5.
- Правительство Австралии, 2016 г., Национальный кадастр загрязнителей, Департамент окружающей среды и энергетики, по состоянию на 16 августа 2016 г.
- Бэрд К. и Кэнн М. 2012, Экологическая химия, 5 изд., В. Х. Фриман и компания, Нью-Йорк,
- ISBN 978-1-4292-7704-4.
- Болдуин Д. Р. и Маршалл В. Дж. 1999, «Отравление тяжелыми металлами и его лабораторное исследование», Анналы клинической биохимии, т. 36, нет. 3. С. 267–300, Дои:10.1177/000456329903600301.
- Болл Дж. Л., Мур А. Д. и Тернер С. 2008, Основные принципы физики Болла и Мура для рентгенологов, 4-е изд., Blackwell Publishing, Чичестер,
- ISBN 978-1-4051-6101-5.
- Bánfalvi G. 2011, «Тяжелые металлы, микроэлементы и их клеточные эффекты», в G. Bánfalvi (ed.), Клеточные эффекты тяжелых металлов, Springer, Dordrecht, pp. 3–28,
- ISBN 978-94-007-0427-5.
- Баранофф Е. 2015, «Комплексы переходных металлов первого ряда для преобразования света в электричество и электричество в свет», в WY Wong (ed.), Металлоорганические соединения и родственные молекулы для преобразования энергии, Springer, Heidelberg, стр. 61–90,
- ISBN 978-3-662-46053-5.
- Береа Э., Родригес-Ибело М. и Наварро Дж. А. Р. 2016, «Металлы платиновой группы — органические каркасы» в С. Каскеле (ред.), Химия металлоорганических каркасов: синтез, характеристика и приложения, т. 2, Wiley-VCH Weinheim, стр. 203–230,
- ISBN 978-3-527-33874-0.
- Бергер А. Дж. И Брунинг Н. 1979, Спутник госпожи Удачи: Как играть . Как получать удовольствие . Как делать ставки . Как выигрывать, Харпер и Роу, Нью-Йорк,
- ISBN 978-0-06-014696-2.
- Берри Л. Г. и Мейсон Б. 1959 г., Минералогия: понятия, описания, определения, W.H. Freeman and Company, Сан-Франциско.
- Биддл Х. и Буш Г. Л., 1949 г., Химия сегодня, Рэнд МакНалли, Чикаго.
- Бончев Д. и Каменска В. 1981, «Предсказание свойств 113–120 трансактинидных элементов», Журнал физической химии, vo. 85, нет. 9. С. 1177–1186, Дои:10.1021 / j150609a021.
- Бонетти А., Леоне Р., Муджиа Ф. и Хауэлл С. Б. (ред.) 2009 г., Платина и другие соединения тяжелых металлов в химиотерапии рака: молекулярные механизмы и клиническое применение, Humana Пресса, Нью-Йорк,
- ISBN 978-1-60327-458-6.
- Бут Х. С. 1957, Неорганические синтезы, т. 5, Макгроу-Хилл, Нью-Йорк.
- Брэдл Х. Э. 2005, «Источники и происхождение тяжелых металлов», Брэдл Х. Э. (ред.), Тяжелые металлы в окружающей среде: происхождение, взаимодействие и восстановление, Эльзевир, Амстердам,
- ISBN 978-0-12-088381-3.
- Брэди Дж. Э. и Холум Дж. Р. 1995, Химия: изучение материи и ее изменений, 2-е изд., Джон Уайли и сыновья, Нью-Йорк,
- ISBN 978-0-471-10042-3.
- Брефоль Э. и МакКрайт Т. (ред) 2001, Теория и практика ювелирного дела, C. Lewton-Brain trans., Brynmorgen Press, Портленд, Мэн,
- ISBN 978-0-9615984-9-5.
- Браун I. 1987, «Астатин: его органоядерная химия и биомедицинские приложения», в Х. Дж. Эмелеус и А. Г. Шарп (редакторы), Успехи неорганической химии, т. 31, Академическая пресса, Орландо, стр. 43–88,
- ISBN 978-0-12-023631-2.
- Брайсон Р. М. и Хаммонд С. 2005, «Общие методологии нанотехнологии: характеристика», в R. Kelsall, I. W. Hamley & M. Geoghegan, Наноразмерная наука и технологии, John Wiley & Sons, Чичестер, стр. 56–129,
- ISBN 978-0-470-85086-2.
- Беркетт Б. 2010, Спортивная механика для тренеров, 3-е изд., Human Kinetics, Champaign, Illinois,
- ISBN 978-0-7360-8359-1.
- Кейси С. 1993, «Реструктуризация работы: новые рабочие места и новые рабочие в постиндустриальном производстве», в R. P. Coulter & I.F. Goodson (ред.), Переосмысление профессионализма: чья это работа / жизнь?, Наши школы / Образовательный фонд «Наше Я», Торонто,
- ISBN 978-0-921908-15-9.
- Чахмурадян А.Р., Смит М. П. и Киники Дж. 2015, «От« стратегического »вольфрама к« зеленому »неодиму: краткий обзор столетия критических металлов», Обзоры рудной геологии, т. 64, январь, стр. 455–458, Дои:10.1016 / j.oregeorev.2014.06.008.
- Чемберс Э. 1743, «Металл «, в Cyclopedia: Или Универсальный словарь искусств и наук (и т. Д.), т. 2, Д. Мидвинтер, Лондон.
- Чендлер Д. Э. и Роберсон Р. В. 2009, Биоимиджинг: современные концепции световой и электронной микроскопии, Jones & Bartlett Publishers, Бостон,
- ISBN 978-0-7637-3874-7.
- Чавла Н. и Чавла К. К. 2013, Композиты с металлической матрицей, 2-е изд., Springer Science + Business Media, Нью-Йорк,
- ISBN 978-1-4614-9547-5.
- Чен Дж. И Хуанг К. 2006, «Новый метод извлечения металлов платиновой группы цианированием под давлением», Гидрометаллургия, т. 82, №№ 3–4, стр. 164–171, Дои:10.1016 / j.hydromet.2006.03.041.
- Чоптуик М. В., Ленер Л. и Преториас Ф. 2015, «Исследование силы тяжести в сильном поле с помощью численного моделирования», в А. Аштекар, Б. К. Бергер, Дж. Изенберг и М. МакКаллум (редакторы), Общая теория относительности и гравитации: вековая перспектива, Издательство Кембриджского университета, Кембридж,
- ISBN 978-1-107-03731-1.
- Clegg B 2014, «Четырехокись осмия «, Мир химии, по состоянию на 2 сентября 2016 г.
- Закрыть F. 2015, Ядерная физика: очень краткое введение, Oxford University Press, Оксфорд,
- ISBN 978-0-19-871863-5.
- Clugston M & Flemming R 2000, Продвинутая химия, Оксфордский университет, Оксфорд,
- ISBN 978-0-19-914633-8.
- Коул М., Линдек П., Халсбанд С. и Галлоуэй Т. С. 2011, «Микропластики как загрязнители в морской среде: обзор», Бюллетень загрязнения морской среды, т. 62, нет. 12. С. 2588–2597, Дои:10.1016 / j.marpolbul.2011.09.025.
- Коул С. Э. и Стюарт К. Р. 2000, «Ядерная и корковая гистология для светлопольная микроскопия «, в Д. Дж. Асаи и Дж. Д. Форни (ред.), Методы клеточной биологии, т. 62, Academic Press, Сан-Диего, стр. 313–322,
- ISBN 978-0-12-544164-3.
- Коттон С. А. 1997, Химия драгоценных металлов, Blackie Academic & Professional, Лондон,
- ISBN 978-94-010-7154-3.
- Коттон С. 2006, Химия лантаноидов и актинидов, переиздано с исправлениями 2007 г., Джон Уайли и сыновья, Чичестер,
- ISBN 978-0-470-01005-1.
- Кокс П. А. 1997, Элементы: их происхождение, изобилие и распространение, Oxford University Press, Оксфорд,
- ISBN 978-0-19-855298-7.
- Крандвелл Ф. К., Моутс М. С., Рамачандран В., Робинсон Т. Г. и Давенпорт В. Г. 2011, Добывающая металлургия никеля, кобальта и металлов платиновой группы, Эльзевьер, Кидлингтон, Оксфорд,
- ISBN 978-0-08-096809-4.
- Цуй X-Y., Li S-W., Zhang S-J., Fan Y-Y., Ma L. Q. 2015, «Токсичные металлы в детских игрушках и ювелирных изделиях: взаимосвязь биодоступности с оценкой риска», Загрязнение окружающей среды, т. 200. С. 77–84. Дои:10.1016 / j.envpol.2015.01.035.
- Дапена Дж. И Тевес М. А. 1982, «Влияние диаметра головки молота на дальность броска молота», Ежеквартальное исследование упражнений и спорта, т. 53, нет. 1. С. 78–81, Дои:10.1080/02701367.1982.10605229.
- Де Зуан Дж. 1997, Справочник по качеству питьевой воды, 2-е изд., John Wiley & Sons, Нью-Йорк,
- ISBN 978-0-471-28789-6.
- Департамент военно-морского флота 2009, Учебная деятельность военно-морских сил залива Аляска: проект заявления о воздействии на окружающую среду / Заявление о воздействии на окружающую среду за рубежом, Правительство США, по состоянию на 21 августа 2016 г.
- Deschlag J. O. 2011, «Ядерное деление», в A. Vértes, S. Nagy, Z. Klencsár, R. G. Lovas, F. Rösch (ред.), Справочник по ядерной химии, 2-е изд., Springer Science + Business Media, Dordrecht, pp. 223–280,
- ISBN 978-1-4419-0719-6.
- Desoize B. 2004, «Металлы и соединения металлов в лечении рака», Противораковые исследования, т. 24, вып. 3а, стр. 1529–1544,
- PMID15274320.
- Дев Н. 2008, «Моделирование судьбы и переноса селена в водно-болотных угодьях Большого Соленого озера», докторская диссертация, Университет Юты, ProQuest, Анн-Арбор, Мичиган,
- ISBN 978-0-549-86542-1.
- Ди Майо В. Дж. М. 2001, Судебная патология, 2-е изд., CRC Press, Boca Raton,
- ISBN 0-8493-0072-X.
- Ди Майо В. Дж. М. 2016, Огнестрельные ранения: практические аспекты применения огнестрельного оружия, баллистики и методов судебной экспертизы, 3-е изд., CRC Press, Бока-Ратон, Флорида,
- ISBN 978-1-4987-2570-5.
- Даффус Дж. Х. 2002, » «Тяжелые металлы» — бессмысленный термин? «, Чистая и прикладная химия, т. 74, нет. 5. С. 793–807, Дои:10.1351 / pac200274050793.
- Данн П. 2009, Необычные металлы могут создать новые лекарства от рака, University of Warwick, по состоянию на 23 марта 2016 г.
- Эббинг Д. Д. и Гаммон С. Д. 2017, Общая химия, 11 изд., Cengage Learning, Бостон,
- ISBN 978-1-305-58034-3.
- Эдельштейн Н. М., Фугер Дж., Кац Дж. Л. и Морсс Л. Р. 2010, «Обобщение и сравнение свойств актиндных и трансактинидных элементов», в Л. Р. Морсс, Н. М. Эдельштейн и Дж. Фугер (редакторы), Химия актинидных и трансактинидных элементов, 4 изд., Т. 1–6, Springer, Dordrecht, стр. 1753–1835,
- ISBN 978-94-007-0210-3.
- Эйслер Р. 1993, Опасность цинка для рыб, диких животных и беспозвоночных: синоптический обзор, Биологический отчет 10, Министерство внутренних дел США, Лорел, Мэриленд, по состоянию на 2 сентября 2016 г.
- Эллиотт С. Б. 1946, Мыла с щелочноземельными и тяжелыми металлами, Reinhold Publishing Corporation, Нью-Йорк.
- Эмсли Дж. 2011, Строительные блоки природы, новое издание, Oxford University Press, Оксфорд,
- ISBN 978-0-19-960563-7.
- Эвертс С. 2016, «Какие химические вещества содержатся в вашей татуировке «, Новости химии и машиностроения, т. 94, нет. 33. С. 24–26.
- Фурнье Дж. 1976, «Связь и электронная структура актинидных металлов», Журнал физики и химии твердого тела, том 37, вып. 2. С. 235–244, Дои:10.1016/0022-3697(76)90167-0.
- Фрик Дж. П. (ред.) 2000, Инженерные сплавы Уолдмана, 9 изд., ASM International, Парк материалов, Огайо,
- ISBN 978-0-87170-691-1.
- Фроммер Х. и Стабулас-Сэвидж Дж. Дж. 2014 г., Радиология для стоматолога, 9 изд., Mosby Inc., Сент-Луис, штат Миссури,
- ISBN 978-0-323-06401-9.
- Гиддинг Дж. К. 1973, Химия, человек и изменение окружающей среды: комплексный подход, Canfield Press, Нью-Йорк,
- ISBN 978-0-06-382790-5.
- Гмелин Л. 1849, Справочник по химии, т. III, Металлы, перевод с немецкого Х. Уоттсом, Кавендишское общество, Лондон.
- Голдсмит Р. Х. 1982, «Металлоиды», Журнал химического образования, т. 59, нет. 6. С. 526–527, Дои:10.1021 / ed059p526.
- Горбачев В. М., Замятнин Ю. С., Лбов А. А. 1980, Ядерные реакции в тяжелых элементах: Справочник по данным, Pergamon Press, Оксфорд,
- ISBN 978-0-08-023595-0.
- Горд Г. И Хедрик Д. 2003, Словарь энтомологии, CABI Publishing, Уоллингфорд,
- ISBN 978-0-85199-655-4.
- Гринберг Б. Р. и Паттерсон Д. 2008 г., Искусство в химии; Химия в искусстве, 2-е изд., Teachers Ideas Press, Вестпорт, Коннектикут,
- ISBN 978-1-59158-309-7.
- Гриббон Дж. 2016, 13.8: Поиски истинного возраста Вселенной и теории всего, Издательство Йельского университета, Новый рай,
- ISBN 978-0-300-21827-5.
- Гшнайднер-младший, К. А. 1975, Неорганические соединения, в К. Т. Горовица (ред.), Скандий: его появление, химия, физика, металлургия, биология и технологии, Академическая пресса, Лондон, стр. 152–251,
- ISBN 978-0-12-355850-3.
- Гуандалини Г. С., Чжан Л., Форнеро Э., Сентено Дж. А., Мокаши В. П., Ортис П. А., Стокельман М. Д., Остербург А. Р. и Чапман Г. Г. 2011, «Распределение вольфрама в тканях у мышей после перорального воздействия вольфрамата натрия», Химические исследования в токсикологии, т. 24, вып. 4. С. 488–493, Дои:10.1021 / tx200011k.
- Гуней М. и Загури Г. Дж. 2012, «Тяжелые металлы в игрушках и недорогих ювелирных изделиях: критический обзор законодательства США и Канады и рекомендации по тестированию», Экологические науки и технологии, т. 48, стр. 1238–1246, Дои:10.1021 / es4036122.
- Хабаши Ф. 2009 г. «Гмелин и его Handbuch », Вестник истории химии, т. 34, нет. 1. С. 30–1.
- Хадхази А. 2016, «Галактическая золотая жила объясняет происхождение самых тяжелых элементов в природе «, Наука в центре внимания, 10 мая 2016 г., по состоянию на 11 июля 2016 г.
- Хартманн В. К. 2005, Луны и планеты, 5 изд., Томсон Брукс / Коул, Белмонт, Калифорния,
- ISBN 978-0-534-49393-6.
- Харви П. Дж., Хэндли Х. и Тейлор М. П. 2015, «Идентификация источников загрязнения металлами (свинцом) в питьевой воде на северо-востоке Тасмании с использованием изотопных составов свинца», Экология и исследования загрязнения окружающей среды, т. 22, нет. 16. С. 12276–12288, Дои:10.1007 / s11356-015-4349-2
- PMID25895456.
- Хасан С. Э. 1996, Геология и обращение с опасными отходами, Prentice Hall, Верхняя Сэдл-Ривер, Нью-Джерси,
- ISBN 978-0-02-351682-5.
- Хоукс С. Дж. 1997, «Что такое« хэви-метал »?», Журнал химического образования, т. 74, нет. 11, стр. 1374, г. Дои:10.1021 / ed074p1374.
- Хейнс В. М. 2015, CRC Справочник по химии и физике, 96-е изд., CRC Press, Бока-Ратон, Флорида,
- ISBN 978-1-4822-6097-7.
- Хендриксон Д. Дж. 2916, «Влияние раннего опыта на мозг и тело», в Д. Аликата, Н. Н. Якобс, А. Герреро и М. Пясецки (редакторы), Проблемная поведенческая наука и психиатрия 2-е изд., Springer, Cham, стр. 33–54,
- ISBN 978-3-319-23669-8.
- Германн А., Хоффманн Р. & Эшкрофт Н. В. 2013, «Конденсированный астат: одноатомный и металлический «, Письма с физическими проверками, т. 111. С. 11604–1–11604–5. Дои:10.1103 / PhysRevLett.111.116404.
- Херрон Н. 2000, «Соединения кадмия», в Энциклопедия химической технологии Кирка-Отмера, т. 4, John Wiley & Sons, Нью-Йорк, стр. 507–523,
- ISBN 978-0-471-23896-6.
- Хоффман Д. К., Ли Д. М. и Першина В. 2011, «Трансактинидные элементы и элементы будущего», в Л. Р. Морсс, Н. Эдельштейн, Дж. Фугер и Дж. Дж. Кац (редакторы), Химия актинидных и трансактинидных элементов, 4 изд., Т. 3, Springer, Dordrecht, pp. 1652–1752,
- ISBN 978-94-007-0210-3.
- Хофманн С. 2002, О вне урана: путешествие к концу таблицы Менделеева, Тейлор и Фрэнсис, Лондон,
- ISBN 978-0-415-28495-0.
- Housecroft J. E. 2008, Неорганическая химия, Эльзевир, Берлингтон, Массачусетс,
- ISBN 978-0-12-356786-4.
- Хауэлл Н., Лейверс Дж., Патерсон Д., Гаррет Р. и Банати Р. 2012, Распределение следов металлов в перьях перелетных и пелагических птиц, Австралийская организация ядерной науки и технологий, по состоянию на 3 мая 2014 г.
- Хюбнер Р., Эстин К. Б. и Герберт Р. Дж. Х. 2010, «Хэви-метал» — время перейти от семантики к прагматике? », Журнал экологического мониторинга, т. 12. С. 1511–1514, Дои:10.1039 / C0EM00056F.
- Икехата К., Джин Ю., Малеки Н. и Лин А. 2015, «Загрязнение водными ресурсами в Китае тяжелыми металлами — возникновение и последствия для общественного здравоохранения», в С. К. Шарма (ред.), Тяжелые металлы в воде: наличие, удаление и безопасность,Королевское химическое общество, Кембридж, стр. 141–167,
- ISBN 978-1-84973-885-9.
- Международная ассоциация сурьмы 2016, Соединения сурьмы, по состоянию на 2 сентября 2016 г.
- Международная ассоциация металлов платиновой группы без даты, Первичное производство металлов платиновой группы (МПГ), по состоянию на 4 сентября 2016 г.
- Исмаил А. Ф., Хулбе К., Мацуура Т. 2015, Газоразделительные мембраны: полимерные и неорганические, Шпрингер, Чам, Швейцария,
- ISBN 978-3-319-01095-3.
- ИЮПАК 2016, «ИЮПАК называет четыре новых элемента — нихоний, московий, теннессин и оганессон. «по состоянию на 27 августа 2016 г.
- Айенгар Г. В. 1998, «Переоценка содержания микроэлементов в Reference Man», Радиационная физика и химия, т. 51, №№ 4–6, с. 545–560, Дои:10.1016 / S0969-806X (97) 00202-8
- Джексон Дж. И Саммит Дж. 2006, Современное руководство по созданию гольф-клуба: принципы и методы сборки и переделки компонентов гольф-клуба, 5-е изд., Торговая компания Hireko, Промышленный город, Калифорния,
- ISBN 978-0-9619413-0-7.
- Järup L 2003, «Опасности загрязнения тяжелыми металлами», Британский медицинский бюллетень, т. 68, нет. 1. С. 167–182, Дои:10.1093 / bmb / ldg032.
- Джонс С. Дж. 2001, Химия d- и f-блоков, Королевское химическое общество, Кембридж,
- ISBN 978-0-85404-637-9.
- Кантра С. 2001, «Что нового», Популярная наука, т. 254, нет. 4, апрель, с. 10.
- Келлер К., Вольф В. и Шани Дж. 2012, «Радионуклиды, 2. Радиоактивные элементы и искусственные радионуклиды», в Ф. Ульманн (ред.), Энциклопедия промышленной химии Ульмана, т. 31, Wiley-VCH, Weinheim, стр. 89–117, Дои:10.1002 / 14356007.o22_o15.
- Кинг Р. Б. 1995, Неорганическая химия элементов основных групп, Вайли-ВЧ, Нью-Йорк,
- ISBN 978-1-56081-679-9.
- Колтхофф И. М. И Элвинг П. Дж. FR 1964, Трактат по аналитической химии, часть II, т. 6, Interscience Encyclopedia, Нью-Йорк,
- ISBN 978-0-07-038685-3.
- Коренман И. М. 1959, «Закономерности свойств таллия», Журнал общей химии СССР, Английский перевод, Бюро консультантов, Нью-Йорк, т. 29, нет. 2. С. 1366–90,
- ISSN0022-1279.
- Козин Л. Ф., Хансен С. С. 2013, Справочник по ртути: химия, применение и воздействие на окружающую среду, RSC Publishing, Кембридж,
- ISBN 978-1-84973-409-7.
- Кумар Р., Шривастава П. К., Шривастава С. П. 1994, «Выщелачивание тяжелых металлов (Cr, Fe и Ni) из посуды из нержавеющей стали в пищевых имитаторах и пищевых материалах», Бюллетень загрязнения окружающей среды и токсикологии, т. 53, нет. 2, Дои:10.1007 / BF00192942 С. 259–266.
- Лах К., Стир Б., Горбунов Б., Мичка В. и Мюр Р. Б. 2015, «Оценка воздействия переносимых по воздуху тяжелых металлов на стрельбищах из оружия», Анналы гигиены труда, т. 59, нет. 3. С. 307–323, Дои:10.1093 / annhyg / meu097.
- Лэндис В., Софилд Р. и Ю. М. Х. 2010, Введение в экологическую токсикологию: молекулярные субструктуры в экологических ландшафтах, 4-е изд., CRC Press, Бока-Ратон, Флорида,
- ISBN 978-1-4398-0411-7.
- Лейн Т. В., Сайто М. А., Джордж Г. Н., Пикеринг И. Дж., Принц Р. К. и Морел Ф. М. М. 2005, «Биохимия: фермент кадмий из морских диатомовых водорослей», Природа, т. 435, нет. 7038, стр. 42, Дои:10.1038 / 435042a.
- Ли Дж. Д. 1996, Краткая неорганическая химия, 5 изд., Blackwell Science, Оксфорд,
- ISBN 978-0-632-05293-6.
- Липер Г. В. 1978, Управление тяжелыми металлами на землеМарсель Деккер, Нью-Йорк,
- ISBN 0-8247-6661-X.
- Лемли А. Д. 1997, «Индекс тератогенной деформации для оценки воздействия селена на популяции рыб», Экотоксикология и экологическая безопасность, т. 37, нет. 3. С. 259–266, Дои:10.1006 / eesa.1997.1554.
- Лиде Д. Р. (ред.) 2004 г., CRC Справочник по химии и физике, 85-е изд., CRC Press, Бока-Ратон, Флорида,
- ISBN 978-0-8493-0485-9.
- Лиенс Дж. 2010, «Тяжелые металлы как загрязнители», в Б. Варф (ред.), Энциклопедия географии, Sage Publications, Thousand Oaks, California, pp. 1415–1418,
- ISBN 978-1-4129-5697-0.
- Лима Э., Герра Р., Лара В. и Гусман А. 2013, «Золотые наночастицы как эффективные противомикробные агенты для кишечная палочка и Сальмонелла тиф » Химия Центральная, т. 7:11, Дои:10.1186 / 1752-153X-7-11
- PMID23331621ЧВК3556127.
- Литасов К. Д., Шацкий А. Ф. 2016, «Состав ядра Земли: обзор», Российская геология и геофизика, т. 57, нет. 1. С. 22–46, Дои:10.1016 / j.rgg.2016.01.003.
- Ливси А. 2012, Передовая инженерия в автоспорте, Рутледж, Лондон,
- ISBN 978-0-7506-8908-3.
- Ливингстон Р. А. 1991, «Влияние окружающей среды на патину статуи Свободы», Экологические науки и технологии, т. 25, нет. 8. С. 1400–1408, Дои:10.1021 / es00020a006.
- Лонго Ф. Р. 1974, Общая химия: взаимодействие материи, энергии и человека, Макгроу-Хилл, Нью-Йорк,
- ISBN 978-0-07-038685-3.
- Любовь М. 1998 г., Поэтапный отказ от использования свинца в бензине: мировой опыт и последствия для политики, Технический доклад Всемирного банка, том 397, Всемирный банк, Вашингтон, округ Колумбия,
- ISBN 0-8213-4157-X.
- Лайман В. Дж. 1995, «Процессы переноса и трансформации», в Основы водной токсикологии, Г. М. Рэнд (редактор), Тейлор и Фрэнсис, Лондон, стр. 449–492,
- ISBN 978-1-56032-090-6.
- Макинтайр Дж. Э. 1994, Словарь неорганических соединений, приложение 2, Словарь неорганических соединений, т. 7, Чепмен и Холл, Лондон,
- ISBN 978-0-412-49100-9.
- Маккей К. М., Маккей Р. А. и Хендерсон В. 2002, Введение в современную неорганическую химию, 6-е изд., Нельсон Торнс, Челтенхэм,
- ISBN 978-0-7487-6420-4.
- Маги Р. Дж. 1969, Шаги к атомной энергии, Чешир для Университета Ла Троб, Мельбурн.
- Мэджилл Ф. Н. I (ред.) 1992, Обзор науки Мэджилла, Серия физических наук, т. 3, Салем Пресс, Пасадена,
- ISBN 978-0-89356-621-0.
- Мартин М. Х. и Кутри П. Дж. 1982, Биологический мониторинг загрязнения тяжелыми металлами, Издательство прикладных наук, Лондон,
- ISBN 978-0-85334-136-9.
- Массарани М. 2015, «В результате катастрофы на шахте в Бразилии выбросы опасных металлов,» Мир химии, Ноябрь 2015 г., по состоянию на 16 апреля 2016 г.
- Мастерс К. 1981, Гомогенный катализ переходными металлами: мягкое искусство, Чепмен и Холл, Лондон,
- ISBN 978-0-412-22110-1.
- Мати Р. Дж. И Бабоян Р. 1986, «Рентгеновский дифракционный анализ патины статуи Свободы», Порошковая дифракция, т. 1, вып. 4. С. 299–304, Дои:10.1017 / S0885715600011970.
- МакКолм И. Дж. 1994, Словарь по керамике и технике, 2-е изд., Springer Science + Business Media, Нью-Йорк,
- ISBN 978-1-4419-3235-8.
- Маккарди Р. М. 1975, Качества и количества: подготовка к химическому колледжу, Харкорт Брейс Йованович, Нью-Йорк,
- ISBN 978-0-15-574100-3.
- МакЛемор В. Т. (ред.) 2008 г., Основы добычи металлов под воздействием воды, т. 1, Общество горного дела, металлургии и разведки, Литтлтон, Колорадо,
- ISBN 978-0-87335-259-8.
- Маккуин К. Г. 2009, Геохимия реголита, в К. М. Скотте и К. Ф. Пейне (редакторы), Наука о реголите, CSIRO Publishing, Коллингвуд, Виктория,
- ISBN 978-0-643-09396-6.
- Меллор Дж. У. 1924, Комплексный трактат по неорганической и теоретической химии, т. 5, Longmans, Green and Company, Лондон.
- Мур Дж. У. и Рамамурти С. 1984, Тяжелые металлы в природных водах: прикладной мониторинг и оценка воздействия, Springer Verlag, Нью-Йорк,
- ISBN 978-1-4612-9739-0.
- Моррис С. Г. 1992, Словарь академической прессы по науке и технологиям, Харкорт Брейс Йованович, Сан Диего,
- ISBN 978-0-12-200400-1.
- Морштейн Дж. Х. 2005, «Толстяк», в E. A. Croddy & Y. Y. Wirtz (ред.), Оружие массового уничтожения: энциклопедия мировой политики, технологий и истории, ABC-CLIO, Санта-Барбара, Калифорния,
- ISBN 978-1-85109-495-0.
- Мозель Б. (ред.) 2005 г., 2004 Национальный оценщик благоустройства дома, Книжная компания ремесленников, Карлсбад, Калифорния,
- ISBN 978-1-57218-150-2.
- Наджа Г. М. и Волески Б. 2009, «Токсичность и источники Pb, Cd, Hg, Cr, As и радионуклидов», в L. K. Wang, J. P. Chen, Y. Hung и N. K. Shammas, Тяжелые металлы в окружающей среде, CRC Press, Бока-Ратон, Флорида,
- ISBN 978-1-4200-7316-4.
- Накбанпоте В., Месунгнеон О. и Прасад М. Н. В. 2016, «Потенциал декоративных растений для фиторемедиации тяжелых металлов и получения дохода», в М. Н. В. Прасаде (ред.), Биоремедиация и биоэкономика, Эльзевир, Амстердам, стр. 179–218,
- ISBN 978-0-12-802830-8.
- Натанс М. В. 1963, Элементарная химия, Prentice Hall, Энглвуд Клиффс, Нью-Джерси.
- Национальный консультативный совет по материалам 1971 г., Тенденции использования обедненного урана, Национальная академия наук — Национальная инженерная академия, Вашингтон, округ Колумбия.
- Национальный консультативный совет по материалам 1973, Тенденции использования вольфрама, Национальная Академия Наук – Национальная инженерная академия, Вашингтон, округ Колумбия.
- Национальная организация по редким заболеваниям 2015, Отравление тяжелыми металлами, по состоянию на 3 марта 2016 г.
- Natural Resources Canada 2015, «Генерация магнитного поля Земли «, по состоянию на 30 августа 2016 г.
- Нибур Э. и Ричардсон Д. 1978, «Лишайники и« тяжелые металлы »», Международный бюллетень лихенологии, т. 11, вып. 1. С. 1–3.
- Нибоер Э. и Ричардсон Д. Х. С. 1980, «Замена невнятного термина« тяжелые металлы »биологически и химически значимой классификацией ионов металлов», Загрязнение окружающей среды Серия B, химическая и физическая, т. 1, вып. 1. С. 3–26, Дои:10.1016 / 0143-148X (80) 90017-8.
- Нзержановски К. и Гавронски С. В. 2012, «Концентрация тяжелых металлов в растениях, произрастающих вблизи железнодорожных путей: пилотное исследование «, Вызовы современных технологий, т. 3, вып. 1. С. 42–45,
- ISSN2353-4419, по состоянию на 21 августа 2016 г.
- Олендорф Х. М. 2003, «Экотоксикология селена», в Д. Дж. Хоффман, Б. А. Раттнер, Г. А. Бертон и Дж. Кэрнс, Справочник по экотоксикологии, 2-е изд., Lewis Publishers, Бока Ратон, стр. 466–491,
- ISBN 978-1-56670-546-2.
- Ондрейчка Р., Кортус Дж. И Гинтер Э. 1971, «Алюминий, его абсорбция, распределение и влияние на метаболизм фосфора», в С. К. Скорина и Д. Уолдрон-Эдвард (редакторы), Поглощение в кишечнике ионов металлов, микроэлементов и радионуклидов, Пергамон пресс, Оксфорд.
- Онг К. Л., Тан Т. Х. и Чунг В. Л. 1997, «Отравление перманганатом калия — редкая причина смертельного отравления», Журнал неотложной медицины, т. 14, вып. 1. С. 43–45, ЧВК1342846.
- Оксфордский словарь английского языка 1989, 2-е изд., Oxford University Press, Oxford,
- ISBN 978-0-19-861213-1.
- Пачеко-Торгал Ф., Джалали С. и Фучич А. (ред.) 2012 г., Токсичность строительных материалов, Издательство Woodhead Publishing, Оксфорд,
- ISBN 978-0-85709-122-2.
- Падманабхан Т. 2001, Теоретическая астрофизика, т. 2, Звезды и звездные системы, Издательство Кембриджского университета, Кембридж,
- ISBN 978-0-521-56241-6.
- Пан В. и Дай Дж. 2015, «ADS на основе линейных ускорителей», в W. Chao & W. Chou (ред.), Обзоры ускорителей науки и техники, т. 8, Приложения-ускорители в энергетике и безопасности, Всемирный научный, Сингапур, стр. 55–76,
- ISBN 981-3108-89-4.
- Пэриш Р. В. 1977, Металлические элементы, Longman, Нью-Йорк,
- ISBN 978-0-582-44278-8.
- Перри Дж. И Вандеркляйн Э. Л. Качество воды: управление природными ресурсами, Blackwell Science, Кембридж, Массачусетс
- ISBN 0-86542-469-1.
- Пикеринг Н. К. 1991, Смычковая струна: наблюдения за дизайном, изготовлением, тестированием и исполнением струн для скрипок, альтов и виолончелей, Амерон, Мэттитак, Нью-Йорк.
- Подосек Ф. А. 2011, «Благородные газы», в H. D. Holland & К. К. Турекян (ред.), Изотопная геохимия: Из «Трактата по геохимии», Elsevier, Амстердам, стр. 467–492,
- ISBN 978-0-08-096710-3.
- Подсики С. 2008, «Тяжелые металлы, их соли и другие соединения «, Новости AIC, Ноябрь, специальный вкладыш, стр. 1–4.
- Прешель Дж. 29 июля 2005 г. «Зеленые пули не так экологичны «, CBS Новости, по состоянию на 18 марта 2016 г.
- Пройс П. 17 июля 2011 г. «Что заставляет Землю готовиться?, «Berkeley Lab, по состоянию на 17 июля 2016 г.
- Прието К. 2011, Приключения виолончели: переработанное издание с новым эпилогом,Техасский университет Press, Остин,
- ISBN 978-0-292-72393-1
- Рагурам П., Сома Раджу И. В. и Шрирамулу Дж. 2010, «Тестирование тяжелых металлов в активных фармацевтических ингредиентах: альтернативный подход», Pharmazie, т. 65, нет. 1. С. 15–18, Дои:10.1691 / тел. 2010.9222.
- Рейнбоу П. С. 1991, «Биология тяжелых металлов в море», в J. Rose (ed.), Вода и окружающая среда, Издательство Gordon and Breach Science, Филадельфия, стр. 415–432,
- ISBN 978-2-88124-747-7.
- Рэнд Г. М., Уэллс П. Г. и Маккарти Л. С. 1995, «Введение в водную токсикологию», в Дж. М. Рэнд (ред.), Основы водной токсикологии: последствия, экологическая судьба и оценка рисков, 2-е изд., Тейлор и Фрэнсис, Лондон, стр. 3–70,
- ISBN 978-1-56032-090-6.
- Ранкин В. Дж. 2011, Минералы, металлы и устойчивость: удовлетворение будущих потребностей в материалах, CSIRO Publishing, Коллингвуд, Виктория,
- ISBN 978-0-643-09726-1.
- Rasic-Milutinovic Z. & Jovanovic D. 2013, «Токсичные металлы», в M. Ferrante, G. Oliveri Conti, Z. Rasic-Milutinovic & D. Jovanovic (ред.), Влияние металлов и родственных веществ в питьевой воде на здоровье, Издательство IWA, Лондон,
- ISBN 978-1-68015-557-0.
- Раймонд Р. 1984, Из огненной печи: влияние металлов на историю человечества, Macmillan, Южный Мельбурн,
- ISBN 978-0-333-38024-6.
- Ребхандл В., Милассин А., Бруннер Л., Штеффан И., Бенко Т., Хёрманн М., Буршен Дж. 2007, «Исследование проглоченных монет in vitro: оставить их или забрать?», Журнал детской хирургии, т. 42, нет. 10. С. 1729–1734, Дои:10.1016 / j.jpedsurg.2007.05.031.
- Редер Д. 2010, Химия в космосе: от межзвездной материи до происхождения жизни, Wiley-VCH, Weinheim,
- ISBN 978-3-527-32689-1.
- Renner H., Schlamp G., Kleinwächter I., Drost E., Lüchow HM, Tews P., Panster P., Diehl M., Lang J., Kreuzer T., Knödler A., Starz KA, Dermann K., Rothaut J., Drieselmann R., Peter C. & Schiele R. 2012, «Металлы и соединения платиновой группы», в F. Ullmann (ed.), Энциклопедия промышленной химии Ульмана, т. 28, Wiley-VCH, Weinheim, стр. 317–388, Дои:10.1002 / 14356007.a21_075.
- Рейес Дж. У. 2007, Экологическая политика как социальная политика? Воздействие свинца в детстве на преступность, Национальное бюро экономических исследований Рабочий документ 13097, по состоянию на 16 октября 2016 г.
- Ридпат I. (ред.) 2012, Оксфордский астрономический словарь, 2-е изд. rev., Oxford University Press, Нью-Йорк,
- ISBN 978-0-19-960905-5.
- Рокхофф Х. 2012, Экономический путь войны Америки: война и экономика США от испано-американской войны до войны в Персидском заливе, Издательство Кембриджского университета, Кембридж,
- ISBN 978-0-521-85940-0.
- Роу Дж. И Роу М. 1992, «В мировых монетах используются 24 химических элемента», Мировые новости чеканки, т. 19, нет. 4. С. 24–25; нет. 5. С. 18–19.
- Рассел А. М. и Ли К. Л. 2005, Структурно-имущественные отношения в цветных металлах, John Wiley & Sons, Хобокен, Нью-Джерси,
- ISBN 978-0-471-64952-6.
- Русиняк Д. Э., Арройо А., Аччиани Дж., Фроберг Б., Као Л. и Фурби Б.2010, «Отравление тяжелыми металлами: управление интоксикацией и антидоты», в А. Луч (ред.), Молекулярная, клиническая и экологическая токсикология, т. 2, Birkhäuser Verlag, Базель, стр. 365–396,
- ISBN 978-3-7643-8337-4.
- Райан Дж. 2012, Личная финансовая грамотность, 2-е изд., Юго-Западный, Мейсон, Огайо,
- ISBN 978-0-8400-5829-4.
- Самсонов Г.В. (ред.) 1968, Справочник по физико-химическим свойствам элементов, Пленум МФИ, Нью-Йорк,
- ISBN 978-1-4684-6066-7.
- Сандерс Р. 2003 г. «Радиоактивный калий может быть основным источником тепла в ядре Земли,» UCBerkelyNews, 10 декабря, по состоянию на 17 июля 2001 г.
- Швейцер П. А. 2003, Металлические материалы: физические, механические и коррозионные свойства, Марсель Деккер, Нью-Йорк,
- ISBN 978-0-8247-0878-8.
- Швейцер Г. К. И Пестерфилд Л. Л. 2010, Водная химия элементов, Oxford University Press, Оксфорд,
- ISBN 978-0-19-539335-4.
- Скотт Р. М. 1989, Химические опасности на рабочем месте, CRC Press, Бока-Ратон, Орландо,
- ISBN 978-0-87371-134-0.
- Скоулос М. (ред.), Вонкеман Г. Х., Торнтон И. и Макуч З. 2001, Ртуть — кадмий — Руководство по устойчивой политике и регулированию тяжелых металлов, Kluwer Academic Publishers, Дордрехт,
- ISBN 978-1-4020-0224-3.
- Селинджер Б. 1978, Химия на рынке, 2-е изд., Издательство Австралийского национального университета, Канберра,
- ISBN 978-0-7081-0728-7.
- Сеймур Р. Дж. И О’Фаррелли Дж. 2012, «Металлы платиновой группы», Кирк-Другой Энциклопедия химической технологии, John Wiley & Sons, Нью-Йорк, Дои:10.1002 / 0471238961.1612012019052513.a01.pub3.
- Шоу Б. П., Саху С. К. и Мишра Р. К. 1999, «Вызванное тяжелыми металлами окислительное повреждение наземных растений», в М. Н. В. Прасед (ред.), Стресс тяжелыми металлами в растениях: от биомолекул до экосистем Шпрингер-Верлаг, Берлин,
- ISBN 978-3-540-40131-5.
- Шедд К. Б. 2002 г. «Вольфрам », Ежегодник минералов, Геологическая служба США.
- Сиджвик Н. В. 1950, Химические элементы и их соединения, т. 1, Oxford University Press, Лондон.
- Сильва Р. Дж. 2010, «Фермий, менделевий, нобелий и лоуренсий», в Л. Р. Морсс, Н. Эдельштейн и Дж. Фугер (редакторы), Химия актинидных и трансактинидных элементов, т. 3, 4-е изд., Springer, Dordrecht, стр. 1621–1651,
- ISBN 978-94-007-0210-3.
- Сполек Г. 2007, «Дизайн и материалы в нахлыстовой рыбалке», в A. Subic (ред.), Материалы в спортивном инвентаре, Том 2, Издательство Woodhead Publishing, Abington, Cambridge, pp. 225–247,
- ISBN 978-1-84569-131-8.
- Станкович С. и Станкочич А. Р. 2013, «Биоиндикаторы токсичных металлов», в E. Lichtfouse, J. Schwarzbauer, D. Robert 2013, Зеленые материалы для энергии, продуктов и удаления загрязнений, Спрингер, Дордрехт,
- ISBN 978-94-007-6835-2С. 151–228.
- Государственное управление водных ресурсов 1987 г., Программа мониторинга токсичных веществ, выпуск 79, часть 20 Отчета о мониторинге качества воды, Сакраменто, Калифорния.
- Технические публикации 1953 г., Пожарная техника, т. 111, стр. 235,
- ISSN0015-2587.
- Общество минералов, металлов и материалов, Дивизион легких металлов 2016, по состоянию на 22 июня 2016 г.
- В Фармакопея США 1985 г., 21-я редакция, Фармакопейная конвенция США, Роквилл, Мэриленд,
- ISBN 978-0-913595-04-6.
- Торн П. К. Л. и Робертс Э. Р. 1943, Фриц Эфраим Неорганическая химия, 4-е изд., Герни и Джексон, Лондон.
- Тиса М. 2001, Физическая металлургия для инженеров, ASM International, Парк материалов, Огайо,
- ISBN 978-0-87170-725-3.
- Токар Э. Дж., Бойд В. А., Фридман Дж. Х. и Уэльс М. П., 2013 г. «Токсическое действие металлов «, в К. Д. Клаассене (ред.), Токсикология Касаретта и Дулла: фундаментальная наука о ядах, 8-е изд., McGraw-Hill Medical, Нью-Йорк,
- ISBN 978-0-07-176923-5, по состоянию на 9 сентября 2016 г. (требуется подписка) .
- Томасик П. и Ратаевич З. 1985, Пиридиновые комплексы металлов, т. 14, вып. 6A, Химия гетероциклических соединений, John Wiley & Sons, Нью-Йорк,
- ISBN 978-0-471-05073-5.
- Топп Н. Э. 1965, Химия редкоземельных элементов, Издательство Elsevier Publishing, Амстердам.
- Торрис М. 2016, «Как свинец оказался в водопроводной воде Флинта,» Новости химии и машиностроения, т. 94, нет. 7. С. 26–27.
- Третьков Е. 2006, «20 марта 1800 г .: Вольта описывает электрическую батарею «, Новости APS, этот месяц в истории физики, Американское физическое общество, по состоянию на 26 августа 2016 г.
- Уден П. С. 2005, «Видообразование селена», в R. Cornelis, J. Caruso, H. Crews & K. Heumann (ред.), Справочник по видам элементов II: виды в окружающей среде, продуктах питания, медицине и гигиене труда, John Wiley & Sons, Чичестер, стр. 346–65,
- ISBN 978-0-470-85598-0.
- Агентство по охране окружающей среды США 1988 г., Критерии качества воды в окружающей водной среде для содержания сурьмы (III), проект, Управление исследований и разработок, Лаборатории экологических исследований, Вашингтон.
- Агентство по охране окружающей среды США 2014, Технические данные — вольфрам, по состоянию на 27 марта 2016 г.
- Правительство США 2014, Список токсичных загрязнителей, Свод федеральных правил, 40 CFR 401.15., По состоянию на 27 марта 2016 г.
- Валкович В. 1990, «Происхождение потребности в микроэлементах живым веществом», в Б. Грубере и Дж. Х. Йоппе (редакторы), Симметрии в науке IV: биологические и биофизические системы, Plenum Press, New York, pp. 213–242,
- ISBN 978-1-4612-7884-9.
- ВанГельдер К. Т. 2014, Основы автомобильных технологий: принципы и практика, Джонс и Бартлетт Обучение, Берлингтон, Массачусетс,
- ISBN 978-1-4496-7108-2.
- Веннер М., Лессенинг М., Панкани Д. и Стрекер Э. 2004, Определение потребностей в исследованиях, связанных с управлением стоком с автомобильных дорог, Совет по транспортным исследованиям, Вашингтон, округ Колумбия,
- ISBN 978-0-309-08815-2, по состоянию на 21 августа 2016 г.
- Венугопал Б. и Лаки Т. Д. 1978, Токсичность металлов для млекопитающих, т. 2, Plenum Press, Нью-Йорк,
- ISBN 978-0-306-37177-6.
- Вернон Р. Э. 2013, «Какие элементы являются металлоидами», Журнал химического образования, т. 90, нет. 12. С. 1703–1707, Дои:10.1021 / ed3008457.
- Волесский Б. 1990, Биосорбция тяжелых металлов, CRC Press, Бока-Ратон,
- ISBN 978-0-8493-4917-1.
- фон Гляйх А. 2013, «Контуры устойчивой металлургической промышленности», в А. фон Гляйх, Р. У. Эйрес и С. Гёсслинг-Райзманн (редакторы), Устойчивое управление металлами, Springer, Dordrecht, стр. 3–40,
- ISBN 978-1-4020-4007-8.
- фон Зеерледер А. 1949, Технология легких металлов, Издательство Elsevier Publishing Company, Нью-Йорк.
- Варт А. Х. 1956, Химия и технология восков, Reinhold Publishing Corporation, Нью-Йорк.
- Уарт С. Р. 1983, «Открытие ядерного деления и парадигмы ядерной физики», в У. Ши (ред.), Отто Хан и рост ядерной физики, Д. Рейдел Издательская компания, Дордрехт, стр. 91–133,
- ISBN 978-90-277-1584-5.
- Вебер Д. Дж. И Рутула В. А. 2001, «Использование металлов в качестве микробицидов для предотвращения инфекций в здравоохранении», в Дезинфекция, стерилизация и консервация, 5-е изд., С.С. Блок (ред.), Липпинкотт, Уильямс и Уилкинс, Филадельфия,
- ISBN 978-0-683-30740-5.
- Велтер Г. 1976, Чистка и консервация монет и медалей, С. Дж. Дерст, Нью-Йорк,
- ISBN 978-0-915262-03-8.
- Белый С. 2010, Динамика снаряда в спорте: принципы и применение, Рутледж, Лондон,
- ISBN 978-0-415-47331-6.
- Виберг Н. 2001, Неорганическая химия, Academic Press, Сан-Диего,
- ISBN 978-0-12-352651-9.
- Виджаявардена М. А., Мегхарадж М. и Найду Р. 2016, «Воздействие, токсичность, воздействие на здоровье и биодоступность смесей тяжелых металлов», в Д. Л. Спаркс, Достижения в агрономии, т. 138, стр. 175–234, Academic Press, Лондон,
- ISBN 978-0-12-804774-3.
- Вингерсон Л. 1986, «Америка убирает свободу «, Новый Ученый, 25 декабря / 1 января 1987 г., стр. 31–35, по состоянию на 1 октября 2016 г.
- Wong MY, Hedley GJ, Xie G., Kölln L.S, Samuel IDW, Pertegaś A., Bolink HJ, Mosman-Colman, E., «Светоизлучающие электрохимические ячейки и органические светоизлучающие диоды, обработанные на растворе, с использованием малых молекул. органические термоактивируемые излучатели замедленной флуоресценции », Химия материалов, т. 27, нет. 19, стр. 6535–6542, Дои:10.1021 / acs.chemmater.5b03245.
- Вульфсберг Г. 1987, Принципы описательной неорганической химии, Издательство Brooks / Cole Publishing Company, Монтерей, Калифорния,
- ISBN 978-0-534-07494-4.
- Вульфсберг Г. 2000, Неорганическая химия, University Science Books, Саусалито, Калифорния,
- ISBN 978-1-891389-01-6.
- Ядав Дж. С., Энтони А., Субба Редди, Б. В. 2012, «Соли висмута (III) как синтетические инструменты в органических превращениях», в Т. Оллевье (ред.), Органические реакции, опосредованные висмутом, Topics in Current Chemistry 311, Springer, Heidelberg,
- ISBN 978-3-642-27238-7.
- Ян Д. Дж., Джолли В. Л. и О’Киф А. 1977, «Превращение водного оксида германия (II) в полуторный герминил» (HGe)2О3«, ‘Неорганическая химия, т. 16, нет. 11. С. 2980–2982, Дои:10.1021 / ic50177a070.
- Юсиф Н. 2007, Геохимия речных наносов штата Колорадо по данным NURE, Коллекция ETD для Техасского университета, Эль-Пасо, бумага AAI3273991.
дальнейшее чтение
Определение и использование
- Али Х. и Хан Э. 2017, «Что такое тяжелые металлы? Давние разногласия по поводу научного использования термина« тяжелые металлы »- предложение всеобъемлющего определения», Токсикологическая и экологическая химия, стр. 1–25, Дои:10.1080/02772248.2017.1413652. Предлагает определять тяжелые металлы как «встречающиеся в природе металлы с атомным номером (Z) более 20 и элементарной плотностью более 5 г / см3. −3 «.
- Даффус Дж. Х. 2002, » ‘ Тяжелые металлы — бессмысленный термин? «, Чистая и прикладная химия, т. 74, нет. 5. С. 793–807, Дои:10.1351 / pac200274050793. Включает обзор различных значений термина.
- Хоукс С. Дж. 1997, «Что такое «хэви-метал»? «, Журнал химического образования, т. 74, нет. 11, стр. 1374, г. Дои:10.1021 / ed074p1374. Взгляд химика.
- Хюбнер Р., Астин К. Б. и Герберт Р. Дж. Х. 2010, » «Хэви-метал» — пора ли переходить от семантики к прагматике? », Журнал экологического мониторинга, т. 12. С. 1511–1514, Дои:10.1039 / C0EM00056F. Обнаруживает, что, несмотря на отсутствие конкретики, этот термин, похоже, стал частью научного языка.
Токсичность и биологическая роль
- Бэрд К. и Кэнн М. 2012, Экологическая химия, 5-е изд., Глава 12, «Токсичные тяжелые металлы», В. Х. Фриман и компания, Нью-Йорк,
- ISBN 1-4292-7704-1. Обсуждает использование, токсичность и распределение Hg, Pb, Cd, As и Cr.
- Нибоер Э. и Ричардсон Д. Х. С. 1980, «Замена невнятного термина« тяжелые металлы »биологически и химически значимой классификацией ионов металлов», Загрязнение окружающей среды, серия B, химическое и физическое, т. 1, вып. 1. С. 3–26, Дои:10.1016 / 0143-148X (80) 90017-8. Широко цитируемая статья, посвященная биологической роли тяжелых металлов.
Формирование
- Хадхази А. 2016, «Галактическая золотая жила объясняет происхождение самых тяжелых элементов в природе «, Наука в центре внимания, 10 мая, по состоянию на 11 июля 2016 г.
- Koehler C. S. W. 2001, «Медицина тяжелых металлов «, Хроники химии, Американское химическое общество, по состоянию на 11 июля 2016 г.
- Моровиц Н. 2006, «Тяжелые металлы», Современные чудеса, сезон 12, серия 14, HistoryChannel.com
- Öhrström L. 2014, «Оксид тантала «, Мир химии, 24 сентября, по состоянию на 4 октября 2016 г. Автор объясняет, как оксид тантала (V) вытеснил мобильные телефоны размером с кирпич. Также доступен как подкаст.
внешняя ссылка
- СМИ, связанные с Тяжелые металлы в Wikimedia Commons
Источник https://mdmetalla.ru/metall/tyazhelye-metally-spisok-vseh.html
Источник https://new-science.ru/14-razlichnyh-tipov-metallov/
Источник https://ru.zahn-info-portal.de/wiki/Heavy_metals




