Очистка воды от тяжелых металлов
Каждый из нас на уроках химии проходил тему тяжелых металлов и немного знаком с ним. Микроэлементы, такие как кадмий, алюминий, барий, свинец, ртуть, медь, цинк, необходимы для нормальной работы организма. Однако повышенное содержание солей тяжелых металлов в питьевой воде приводит к их накапливанию в живых организмах.
Очистка питьевой воды от тяжелых металлов
Тяжелые металлы попадают в воду двумя способами:
- Природным. Земная кора содержит огромное количество химических элементов. Их концентрация в верхних слоях зависит от географического и геологического факторов. Грунтовые воды, проходящие через различные горные породы, растворяют в себе эти соединения. В воздухе также присутствуют вредные взвешенные вещества, которые при определенных погодных явлениях (дождь, снегопад, гроза) попадают в верхние слои литосферы и гидросферы.
- Антропогенным. Открытие нефти, появление первых фабрик и заводов, развитие промышленности быстрыми темпами привели к увеличению стоков, насыщенных загрязняющими веществами, в том числе и тяжелыми металлами. Пищевая промышленность, ТЭЦ, химические предприятия, гальваническое производство, переработка и добыча нефтепродуктов, использование удобрений в аграрном хозяйстве — все это наносит непоправимый вред живым организмам. Каждый год человечество отравляет природу продуктами своей жизнедеятельности. Но сказывается ли это на жизни людей?
Влияют ли тяжелые металлы на живые организмы
Человек не может прожить без воды более 3-х суток. Каждый день необходимо выпивать до 2 литров воды в день. Но какой будет эффект, если ежедневно употреблять воду, насыщенную разными загрязнителями?
Тяжелые металлы, растворенные в воде, попадает в организм человека через пищевые цепи или путем попадания внутрь с питьевой водой. Каждый элемент аккумулируется в определенном органе (печень, почки, костные ткани и т.п.) и приводит к нарушению его работы, а значит и функционированию всего организма. Токсичный эффект ксенобиотиков сохраняется на протяжении долгого времени. Поэтому очень важно не допустить накапливание ионов тяжелых металлов в своем организме.
Основные способы и методы очистки воды от тяжелых металлов
Развитие области водоподготовки не стоит на месте, появляются новые технологии очистки воды от ионов тяжелых металлов. Для того, чтобы правильно подобрать оборудование для удаления тяжелых металлов из воды нужно провести химический анализ воды. Как самостоятельно отобрать пробы Вы можете узнать здесь. Наиболее доступные и эффективными являются следующие методы удаления из воды ионов тяжелых металлов:
Обратноосмотическая установка. Очистка воды от солей тяжелых металлов происходит на специальных мембранах, которые задерживают ионы различных солей. С помощью этой системы очистки воды от сульфатов и тяжелых металлов происходит разделение исходной воды на очищенную и загрязненную. Чистая вода подается потребителю, а концентрированный раствор уходит в дренаж.
- Для очистки воды в промышленности от тяжелых металлов, Мы разрабатываем промышленный обратный осмос различной производительности (до 50 м3/ч). Такая установка очистки природных вод от тяжелых металлов позволяет получать очищенную воду в непрерывном режиме и удаляет весь комплекс загрязняющих веществ.
- Если Вы обнаружили тяжелые металлы в воде из своей скважины или колодца и вам необходима очистка воды от них, Мы советуем приобретать бытовую установку очистки воды от ртути, свинца и кадмия на основе обратного осмоса AP-600. Эта 5-ступенчатая установка прекрасно справляется с проблемой грязной воды в доме.
Фильтры для очистки воды от солей тяжелых металлов на основе ионообменных смол. Вода поступает на систему фильтрации, где прогоняется через фильтрующую среду. Однако, если в вашей воде растворено большое количество разных тяжелых металлов, такой способ реагентной очистки воды от тяжелых металлов будет не эффективным. Ионообменная смола подбирается индивидуально под каждый тип загрязняющего вещества и очищает воду только от него.
Установка электродиализа. Принцип работы основан на прохождение потока воды через мембраны под действием электрического тока. В процессе химической реакции токсичные вещества оседают на стенках мембран, которые способны пропускать только положительно или отрицательно заряженные элементы (анионы уходят к аноду, катионы к катоду). Такой способ очень дорогой и используется в редких случаях.
Почему клиенты доверяют нам
Компания Diasel Engineering на рынке с 2013 года. За это время мы изучили эту отрасль и можем Вам гарантировать качественное и надежное обслуживание при очистке воды от тяжелых металлов.
Уже сегодня Вы можете оставить заявку на нашем сайте или написать нам на электронную почту info@diasel.ru, а также связаться со специалистами по телефону 8-499-391-39-59.
Мы подберем различные варианты сорбентов для очистки воды от тяжелых металлов, которые будут наиболее эффективны для решения Вашей проблемы, а уже завтра Вы сможете наслаждаться чистой водой в своем доме или на промышленном предприятии.
В наличии большой выбор установок обратного осмоса и ионообменных фильтров для очистки промышленных вод от тяжелых металлов.
Заявка на подбор оборудования
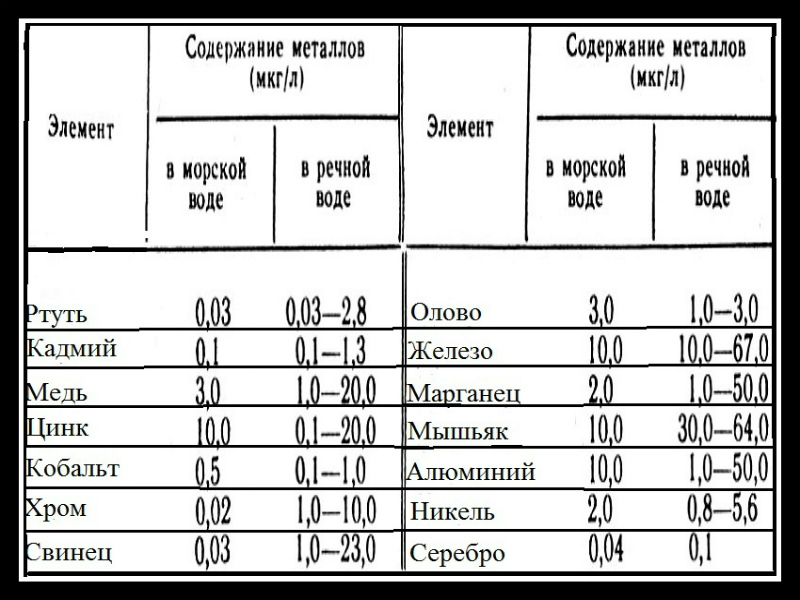
Тяжелые металлы в воде
![]()

Очистка воды
Автор admin На чтение 5 мин Просмотров 164 Опубликовано 09.08.2022
Давайте сегодня обсудим противоречивую тему тяжелых металлов в воде. Тяжелые металлы представляют собой глобальную проблему из-за их воздействия на здоровье человека и окружающую среду.
Основными тяжелыми металлами, содержащимися в питьевой воде, являются свинец, мышьяк, ртуть, кадмий, марганец и медь. Эти металлы токсичны и наносят вред вашему здоровью. Питьевая вода контролируется на наличие и концентрацию тяжелых металлов.
Что такое тяжелые металлы в воде?
В той или иной степени следовые количества тяжелых металлов всегда присутствуют в нашей питьевой воде. В целом они не вредны для нашего здоровья. Как мы обсуждали, когда подходили к вопросу об общем количестве растворенных твердых веществ, некоторые элементы в нашей воде безопасны и даже полезны для здоровья, если они не превышают определенных пороговых значений.
К сожалению, не все тяжелые металлы одинаковы. Например, железо и цинк являются питательными веществами, которые необходимы для вашего здоровья.
- Железо позволяет вашим эритроцитам связывать молекулы кислорода;
- Ваше тело требует цинка для правильной работы.
Однако слишком много любого из них может привести к симптомам отравления тяжелыми металлами. К счастью, мы, как правило, не подвергаемся воздействию таких металлов в опасных количествах, и, вероятно, поэтому мы не так часто слышим о таких проблемах. Тем не менее, когда такое разоблачение происходит, на ум приходит случай кризиса Флинта.

Тем не менее реальность такова, что многие тяжелые металлы в нашей питьевой воде опасны. Когда они попадают в нашу питьевую воду, мы становимся уязвимыми для некоторых рисков для здоровья.
Вот почему так важно обсуждать наличие тяжелых металлов в нашей питьевой воде:
Тяжелые металлы обычно присутствуют в природных водах в следовых количествах, но многие из них токсичны даже при очень низких концентрациях. Такие металлы, как мышьяк, свинец, кадмий, никель, ртуть, хром, кобальт, цинк и селен, высокотоксичные даже в незначительных количествах. Растущее количество тяжелых металлов в наших ресурсах в настоящее время вызывает большую озабоченность, особенно в связи с тем, что большое количество промышленных предприятий сбрасывает содержащие металл сточные воды в пресную воду без какой-либо надлежащей очистки.
Наиболее распространенные тяжелые металлы в воде
По данным Ассоциации качества воды, мы выпиваем много металлов и тяжелых металлов с каждой чашкой воды. Однако некоторые из наиболее тревожных из них перечислены ниже.
- Свинец. Свинец считается токсичным на любом уровне, даже в небольших количествах. Он может накапливаться в вашем теле с течением времени. Он вызывает повреждение головного мозга, печени, почек, сердца, головного мозга и костей. Потребление свинца в течение определенного периода времени может вызвать дисфункцию нервной системы, заболевание почек, повреждение иммунной системы и ревматоидный артрит.
- Мышьяк. Мышьяк очень токсичен. Воздействие было связано с раком, вызывало неврологические проблемы, сердечно-сосудистые заболевания, нарушения иммунной системы и диабет.
- Кадмий. Кадмий вызывает рак у людей. Международное агентство по изучению рака относит кадмий к группе 1. Эта категория используется при наличии достаточных доказательств канцерогенности для человека. Также известно, что он вызывает повреждение почек, печени, опорно-двигательного аппарата, костей и крови.
- Медь. Высокие уровни воздействия меди могут вызывать такие вредные последствия, как раздражение рта, носа и глаз, диарея, спазмы желудка, рвота и тошнота. Младенцы в возрасте до одного года и люди с болезнью Вильсона особенно чувствительны к меди.
- Марганец. Воздействие высоких уровней марганца может вызвать состояние, называемое манганизмом. Болезнь похожа на болезнь Паркинсона и наблюдается у рабочих-металлистов, подвергшихся воздействию высоких уровней марганца.
Существует около сорока веществ, которые принято считать тяжелыми металлами. Их атомная масса составляет больше, чем 50 а.е. Очень интересен тот факт, что практически все элементы (кроме свинца, ртути, кадмия, висмута) являются очень важными.
Особенно от загрязнения тяжелыми металлами страдают открытые водоемы, так как их загрязняют сточные воды разных заводов. Особенно это касается машиностроительных заводов, потому что у них имеется гальванопроизводство. В таких сточных водах находятся ионы тяжелых металлов. Такую воду необходимо обязательно глубоко очищать.
Очистка воды от тяжелых металлов чаще всего проводится методом химического осаждения (методом нейтрализации). В сточных водах специально повышают уровень рН до 8-10.
Когда повышается величина рН, то в воде возникает избыток ионов ОН. В результате ионы тяжелых металлов начинают выпадать и в форме гидроксидов в осадок. Но этот метод лишь частично позволяет удалить из жидкости тяжелые металлы, в последующем необходима доочистка.
Химическое осаждение и его эффективность
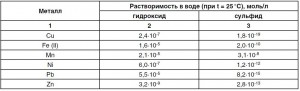
Очистка сточных вод от тяжелых металлов настолько эффективна, насколько растворимы образующиеся соединения. Есть такие виды тяжелых металлов, которые очень плохо растворяются. Для повышения очистки жидкости от этих веществ можно использовать реагенты осадители, в которых содержатся соединения сульфата. Вступая в реакцию с тяжелыми металлами, ионы сульфида образуют некие химические соединения, которые самые меньшие по растворимости.
Таблица растворимости тяжелых металлов в воде
Определение тяжелых металлов в воде проводится по-разному. Существует много способов сделать это. Их содержание в средах воды можно определить с помощью физико-химического анализа, химического анализа. Зависимо от того, какое количество анализируемого продукта могут быть использованы такие способы определения:
- Микроанализ;
- Макроанализ;
- Полумикроанализ.
Есть два основных вида методов, с помощью которых можно провести определение. Это спектрометрические методы и электрохимические.
Загрязнение вод тяжелыми металлами может стать причиной увеличения количества мутаций, которые могут передаваться по наследству. В результате могут возникать пороки умственного развития и физического развития. Это действительно очень опасно, поэтому очень важно чистить воды от таких вредных веществ, как тяжелые металлы.
Железо в сточных водах: очистка и допустимая концентрация

Неочищенные производственные стоки, содержащие немалую часть таблицы Менделеева, опасны для окружающей среды и человека.
Сточные воды поступают в природные водоемы, где соли тяжелых металлов и другие опасные примеси накапливаются в воде и донных отложениях, становясь источником вторичного загрязнения.
Примеси выпадают в осадок в виде карбонатов, сульфатов, частично адсорбируются на минеральных и органических частицах. Концентрация опасных загрязнений в отложениях постепенно нарастает.
Когда адсорбционные свойства осадка исчерпываются, тяжелые металлы концентрируются в воде, что приводит к экологическому кризису.
Разбираемся, почему в промышленных водах много Fe и откуда оно берется, какие ПДК железа установлены для разных водоемов и сточных вод, какие способы очистки наиболее эффективны.
Откуда железо берется?
Сточные воды, содержащие Fe и другие тяжелые металлы, образуются в:
- металлургической;
- машиностроительной;
- металлообрабатывающей;
- текстильной;
- лакокрасочной;
- химической промышленности;
- при обработке металлических поверхностей;
- при производстве гальванических элементов;
- в электронной промышленности;
- в типографиях;
- на кожевенных фабриках и в других сферах.
Стоки после обработки на водопроводных очистных сооружениях обычно содержат небольшой объем Fe, не превышающий гигиенические нормы.

В результате прохождения многокилометровой системы подверженных коррозии стальных труб стоки подвергаются вторичному загрязнению. В результате вновь образуется излишне «железистая» вода с желтоватым оттенком.
В воде Fe чаще присутствует в форме бикарбоната, закиси, сульфида. Гидрохимические закономерности приводят к образованию «союзов» железа и марганца – часто при определении одного вещества обнаруживается и другое. Концентрация Fe в СВ зависит от уровня углекислоты – в кислых средах растворимость соединений металла возрастает, а в щелочных – уменьшается.
Соли двухвалентного Fe «коварны», они характеризуются хорошей растворимостью и не задерживаются фильтрами. Поэтому очищенная прозрачная вода на воздухе способна вдруг резко помутнеть, приобретая характерный рыжевато-бурый цвет.
Причина такой трансформации – особенность соединений двухвалентного Fe при взаимодействии с кислородом воздуха быстро окисляться, преобразуясь в нерастворимую форму трехвалентного Fe, вещество с бурой окраской – ржавчину. Сами растворы Fe (II)+ и Fe (III)+ практически бесцветны.
Вода с превышением Fe способна испортить трубопроводы и узлы очистных систем, благоприятна для развития железобактерий, осложняющих работу гидротехнических сооружений.
Продукты жизнедеятельности железобактерий обладают канцерогенными свойствами. Железосодержащие обрастания в полости труб – идеальные условия для развития опасных микроорганизмов (кишечной палочки, патогенных бактерий).
Железо – биологически активный элемент, влияющий на интенсивность развития фитопланктона и качественный состав микрофлоры в природных водоемах. Концентрация элемента выше 1-2 мг/л значительно ухудшает органолептические свойства, придавая воде неприятный вяжущий вкус. Вода становится малопригодной и для технических нужд.
Перечисленные факторы ухудшают химические и бактериологические показатели воды. Кроме того, Fe, наряду с другими веществами, повышает жесткость воды.

Учитывая негативные последствия высокой концентрации этого представителя группы тяжелых металлов, важно подобрать оптимальный метод очистки, регулярно проводить химический анализ стоков.
Определение концентрации
Железо образует растворимые соли, при этом в растворе элемент может находиться и в других формах:
- истинного раствора, аквакомплекса (Fe (II));
- нерастворенного (Fe (III)) – в виде взвешенных минеральных частиц (железосодержащих минералов, гидрата оксида Fe, соединений Fe, сорбированных на взвесях) размером более 0,45 мкм;
- коллоидных растворов (тонкодисперсной взвеси), образующихся в результате распада агрегированных частиц под воздействием органики;
- комплексных соединений;
- железоорганики;
- железобактерий.
Учитывая «многоликость» элемента за счет существования в разных формах и состояниях, в лабораториях стоки анализируются на суммарное Fe – «общее железо».
Раздельное определение нерастворимых и растворимых форм двухвалентного и трехвалентного Fe показывает менее точные результаты. Диапазон определяемых концентраций металла – 0,1–1,5 мг/л. Определение возможно и при показателях свыше 1,5 мг/л после разбавления пробы чистой водой.
ПДК
Содержание Fe в воде нормируется в виде ПДК для хозяйственно-питьевого и рыбохозяйственного водопользования.
ПДК общего Fe в питьевой воде установлены СанПиН 1.2.3685-21 и составляют 0,3 мг/дм 3 (лимитирующий показатель вредности – органолептический).
В систему канализации могут быть приняты производственные стоки, которые не вызывают нарушения в работе канализационных сетей и сооружений, не угрожают безопасности их эксплуатации и могут быть обработаны одновременно с городскими сточными водами до установленных требований.
ПДК Fe в воде, предназначенной для отведения в бытовую канализацию, ограничены 5 мг/дм 3 , для водоемов рыбохозяйственного значения еще более жесткие – 0,1 мг/дм 3 . Нормативный показатель установлен приказом Минсельхоза России № 552.
Методы очистки стоков
При выборе технологии очистки стоков от солей тяжелых металлов, в том числе и Fe, приоритет отдается наиболее энергосберегающим методам, а также способам, максимально извлекающим металл для вторичного использования.
Окисление
Окисление, как метод очистки от железа в любых видах, проводится с использованием кислорода воздуха или аэрацией, а также путем введения в раствор окислителей:
- хлора;
- перманганата калия;
- перекиси водорода;
- озона
с последующим осаждением и фильтрацией.
В качестве вспомогательного способа иногда применяется коагуляция. Реакция окисления Fe – продолжительный процесс, требующий больших емкостей, в которых можно обеспечить требуемое время контакта. Добавки-окислители ускоряют очистку.

Часто применяется хлорирование – метод, при котором очистка воды совмещена с дезинфекцией. Наиболее мощный окислитель – озон. Но аппараты для его производства сложны, дороги, энергозатратны. Кроме того, в концентрированном виде озон ядовит и требует тщательного дозирования для максимально точного соблюдения пропорций.
Частицы окисленного Fe ничтожно малы (1-3 мкм), поэтому долго осаждаются. Для укрупнения и ускорения осаждения «потяжелевших» частиц в раствор вводятся коагулянты – химические вещества, обладающие нужными качествами.
Коагуляция особенно необходима в городских очистных системах, где стоки обычно обрабатываются на песчаных или антрацитовых осветлительных фильтрах, не способных задерживать мелкие примеси.
- Если не использовать коагулянты, окисленный металл осаждается слишком долго, а фильтрация некоагулированных частиц затрудняется из-за их малых размеров.
- Методы окисления (в меньшей степени это относится к озонированию) бессильны, если в воде содержится органическое Fe.
- Железо обычно содержится в воде вместе с марганцем, который вступает в реакции окисления намного сложнее, чем Fe, требуя при этом более высоких значений рН.
Из-за перечисленных минусов технология не подходит для небольших очистных сооружений, работающих на больших скоростях.
Каталитическое окисление с последующей фильтрацией
Технология применяется для очистки стоков в высокопроизводительных компактных системах. Окисление металла происходит на поверхности гранул фильтрующей среды с функциями катализатора. Как правило, фильтрующую засыпку делают из материалов, содержащих диоксид марганца.
Fe в присутствии диоксида марганца быстро окисляется и оседает на фильтрующих гранулах, затем основная масса окисленного Fe при обратной промывке вымывается в дренаж.
Для улучшения качества очистки в воду добавляются дополнительные реагенты-окислители, например, перманганат калия. Последний не только активизирует реакции, но и регенерирует марганец, компенсируя его вымывание с поверхности фильтрующего материала.
Недостатки каталитического окисления:
- Метод неэффективен в отношении органического Fe. Кроме того, если в воде присутствует органическое Fe, фильтрующие гранулы со временем покрываются органической пленкой, изолирующей катализатор (диоксид марганца) от воды. В результате каталитическая способность фильтрующей среды становится нулевой. Удалять Fe фильтрующий материал также не сможет, так как таким фильтрам не хватает времени, чтобы произошло естественное окисление.
- Если концентрация Fe в воде более 15 мг/л, каталитические системы оказываются неэффективными. Реакции становятся особенно слабыми, если в стоках присутствует марганец.
Ионный обмен
Ионный обмен основан на использовании природных ионитов (цеолитов, сульфоуглей) и синтетических ионообменных смол. Катиониты способны удалять растворенное двухвалентное Fe, присутствующее в СВ практически в любых концентрациях.

Основные преимущества технологии ионного обмена:
- Устойчивость к воздействию частого спутника железа – марганца, значительно осложняющего работу окисляющих установок.
- Во время ионного обмена удаляются железо и марганец в растворенном состоянии. Необходимость в проведении такого капризного и «грязного» (приходится периодически вымывать ржавчину) этапа, как окисление, отпадает.
Недостатки ионного обмена с использованием искусственных смол:
- Использование катионитов целесообразно для очистки чрезмерно жестких стоков, Fe удаляется из воды вместе с жесткостью. Для вод с нормальной жесткостью использование катионообменных смол нерационально.
- Смолы «не любят» трехвалентное Fe, которое их «забивает», плохо вымывается. Если в воде присутствует уже окисленное Fe, а также растворенный кислород и другие окислители, способствующие его образованию, метод лучше не использовать.
- Если содержание Fe в СВ высоко, возрастает вероятность образования нерастворимого трехвалентного Fe (негативные последствия описаны выше), быстро истощается ионообменная емкость смолы. В результате возникает необходимость частой регенерации материала.
- Присутствие в воде органики (в том числе и органического Fe) приводит к быстрому появлению на поверхности смолы органической пленки, которая ухудшает свойства катионита, является питательной средой для бактерий.
Мембранные технологии
Метод заключается в пропускании воды под давлением через полупроницаемую мембрану. В результате над мембраной образуется концентрат тяжелых металлов, а под мембраной – очищенный раствор.
Удаление Fe мембранным способом, который предназначен для глубокой доочистки путем удаления бактерий, простейших и вирусов, а также обессоливания (подготовки высококачественной питьевой воды) – не цель, а побочный эффект.
Поэтому использование мембран не является традиционным способом очистки воды от Fe.
- микрофильтрационные мембраны удаляют уже окисленное трехвалентное Fe;
- ультра- и нанофильтрационные мембраны удаляют коллоидное и бактериальное Fe;
- обратноосмотические мембраны удаляют слабо поддающееся другому воздействию растворенное органическое и неорганическое Fe.
Недостатки применения мембран:
- Мембраны даже в большей степени, чем фильтрующие гранулы и ионообменные смолы, склонны зарастать органикой и покрываться ржавчиной. Подобные системы нуждаются в тщательном предварительном удалении из исходной воды взвесей и органических загрязнений. Другими словами, мембранные установки применимы там, где в воде не присутствует органическое, коллоидное, бактериальное и трехвалентное Fe, либо эти примеси удалены на первых стадиях очистки.
- Мембранные установки не относятся к числу бюджетных, поэтому их использование рентабельно в условиях необходимого достижения высокого качества воды (например, в пищевой промышленности).
Дистилляция
Принцип дистилляции фактически воплощает круговорот воды в природе. При испарении вода практически полностью освобождается от примесей.

В дистилляторах для ускорения естественного процесса испарения применяется нагревание водного раствора до температуры кипения, что приводит к интенсивному парообразованию. При этом механические загрязнения оказываются слишком тяжелыми, чтобы быть подхваченными паром.
Одновременно почти все растворенные соединения (включая соли Fe) за счет увеличения температуры и растущей по мере испарения жидкости концентрации достигают пиковых значений своей растворимости и выпадают в осадок.
Затем пар охлаждается в дистилляторах, конденсируется, вновь превращаясь в воду.
Дистиллированная вода используется в:
- медицине;
- фармацевтике;
- в химических производствах;
- на промышленных предприятиях.
- низкая производительность;
- необходимость частого удаления осадка и накипи;
- излучение тепла от оборудования;
- высокий расход электроэнергии.
Выделение железа из кислого раствора
Способ применим для обработки кислых СВ, содержащих ионы двухвалентного Fe, химической и гидрометаллургической промышленности.
Технология выделения железа реализуется так:
- Вода подается в реактор с псевдоожиженным слоем с объемной скоростью потока, достаточной для эффективного псевдоожижения и перемешивания.
- В реакторе двухвалентное Fe окисляется микробами определенных групп до трехвалентного Fe.
- Кислотность среды раствора доводится до значений от 2 до 4.
- В концентраторе из раствора осаждаются твердые примеси – соединения серы и трехвалентного Fe.
Очистка стоков на глауконите от катионов железа (II)
Метод сорбции катионов двухвалентного Fe адсорбентом – 95% концентратом глауконита. Катионы Fe извлекают из стоков при высоте поглощающего слоя до 10 см и линейной скорости потока до 5 м/ч. Эффективность извлечения металла экологически чистым и доступным природным адсорбентом достигает максимальных значений – до 99,9%.
Использование фильтров-обезжелезивателей
Безреагентные обезжелезиватели представляют собой баллон с клапаном фильтрации, в который засыпают фильтрующий материал.

Засыпка служит катализатором реакции окисления марганца и железа кислородом, растворенным в воде, или гипохлорит натрия (в этом случае устанавливаются угольные фильтры). Предварительная аэрация улучшает качество окисления, увеличивает период эксплуатации наполнителя.
Использование электролизера
Предварительно очищенная от механических включений сточная жидкость пропускается через электролизер – цилиндрическую электролитическую емкость. Поток последовательно проходит сначала через анодную, а затем через катодную секцию.
Затем вода пропускается через песок. Одновременно происходит отбор выделяющихся газов и периодический смыв с поверхности песчинок налипшего слоя соединений Fe и других примесей.
Окисление в присутствии катализатора
Технология подходит для очистки сточных вод гальванических процессов, стоков линий цинкования и кадмирования.
Метод заключается в одновременном комбинированном окислении озоном и пероксидом водорода в присутствии гетерогенного катализатора пористых керамических материалов (отходов металлургического производства), содержащих переходные металлы и их оксиды.
Расход катализатора составляет 5-10 см 3 на 1 дм 3 сточных вод. Кроме Fe, из стоков эффективно удаляются другие токсичные металлы – кадмий, цинк, а также аммиак.
Интересное видео
Предлагаем посмотреть, как сделать мини-станцию для очистки воды от железа своими руками:
Заключение
В зависимости от окислительно-восстановительного потенциала природных и сточных вод железо существует в виде двух- и трехзарядных ионов, при этом может быть одновременно во многих формах. Поэтому анализ стоков на содержание Fe проводится по показателю «Железо общее».
Технология очистки железосодержащих стоков подбирается по принципу достижения ПДК (с учетом категории приемника стоков) и экономической целесообразности.
Если концентрация Fe в воде стабильно высока, предпочтение отдается методам, направленным на максимальное извлечение металла как вторичного сырья.
Источник https://diasel.ru/article/ochistka-vody-ot-tyazhelyh-metallov/
Источник https://vseowode.ru/ochistka/tyazhelye-metally-v-vode.html
Источник https://rcycle.net/stochnye-vody/zhelezo-ochistka-i-dopustimaya-kontsentratsiya





