Восстановление в доменной печи окислов марганца, кремния, фосфора и других элементов
В шихте содержатся некоторые количества окислов и более сложных соединений марганца, кремния, фосфора и в отдельных случаях легирующих и цветных металлов (хрома, ванадия, никеля и др.).
Ввиду различной термодинамической прочности окислов и соединений по ходу доменного процесса они восстанавливаются при различных условиях и с различной полнотой. Определенное влияние при этом оказывает химический характер окислов (основной или кислотный), определяющий их активность в соединениях и шлаке, а также химическое сродство восстанавливаемого элемента к железу и углероду, находящимся в чугуне. Некоторые вносимые в печь окислы (Al2O3, CaO, MgO) являются настолько химически прочными, что практически не подвергаются восстановлению — полностью переходят в шлак.
Восстановление марганца
В шихтовых материалах марганец находится в виде окислов MnO2, Mn2O3 (руды) или окислов Mn3O4, MnО и более сложных соединений (агломераты). Начальные стадии восстановления высших окислов протекают легко при минимальных содержаниях СО в газовой фазе. Упругость диссоциации для MnO2 и Mn2O3 достигает 101,325 кн/м 2 (1 aт) при 565 и 1090° С соответственно. Перекись марганца MnO2 энергично восстанавливается до Mn2O3 и частично до Mn3O4 на верхних горизонтах засыпи при 300—400° С с выделением тепла. Восстановление Mn2O3 и Mn3O4 происходит в шахте печи при 400—800° С. При использовании марганцовистого агломерата высшие окислы Mn восстанавливаются при агломерации.
Однако закись марганца MnО весьма трудно восстановима. Ее восстановление происходит лишь с участием углерода и с затратой тепла, вдвое большей, чем при восстановлении FeO. Термодинамически осуществление этого процесса в стандартных условиях (аMnO= аMn = аC = 1, рCO = 1 aт) становится возможным, начиная с 1430° С.
В доменной печи MnО восстанавливается в несколько других условиях. При восстановленном металлическом железе и избытке углерода восстанавливаемый марганец переходит в металлический раствор (чугун), где может быть частично связан с углеродом в виде карбида. Таким образом, его термодинамическая активность, особенно в начале процесса восстановления, значительно меньше единицы. Это обстоятельство обеспечивает восстановление марганца углеродом при более низких температурах, чем 1430° С. Однако восстановление марганца затрудняет образование соединений MnО с SiO2 (силикатов) и переход невосстановленной закиси марганца в доменный шлак. Исследования доменного процесса показывают, что большая часть МnО не успевает восстанавливаться до начала процесса шлакообразования и оказывается в составе шлаковой фазы. Образование силиката марганца из смеси его составляющих протекает очень интенсивно, начиная с 1100° С. По данным лабораторных исследований, восстановление марганца из закиси в смеси с активным древесным углем при 1300° С за час протекает на 34—38%, в то время как восстановление его из силиката при тех же условиях протекает лишь на 4,2%. Наличие извести в контакте с силикатами марганца значительно облегчает и ускоряет восстановление марганца. Для указанных выше условий степень восстановления марганца составила около 17%. При этом протекают следующие реакции:
вытеснение MnО из силиката
MnО·SiO2 + 2СаО = 2СаО·SiO2 + MnО +110 кдж/моль (26,24 ккал/моль)
восстановление MnО углеродом
MnО + С = Mn + СО—288,8 кдж/моль (—68,93 ккал1моль);
суммарная реакция MnO·SiO2 + 2СаО + С = Mn + 2CaO-SiO2 + СО — 178,8 кдж/моль (—42,69 ккал/моль).
При образовании жидких фаз активность закиси марганца в шлаках с высоким содержанием SiO2 остается пониженной, что затрудняет восстановление марганца в металлический раствор.
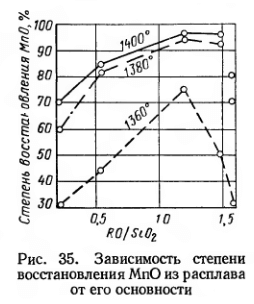
Поэтому благоприятные условия восстановления марганца создаются при значительном содержании в шлаке СаО. Эти условия достигаются раньше в случае применения офлюсованного агломерата с повышенной основностью. Закись марганца, будучи более слабым основанием, чем СаО, в присутствии последней имеет более высокую активность. Однако чрезмерное повышение основности шлака может привести к ухудшению условий восстановления марганца по, кинетическим причинам, из-за значительного повышения вязкости шлака. Условия восстановления марганца из расплава с высоким содержанием MnО при различной величине основности демонстрирует рис. 35. Повышение основности шлака до величины RO/SiO2 = 1,2 увеличивает степень восстановления MnО.
При низкой температуре (1360° С) наблюдается уменьшение степени восстановления при повышении основности.
В доменной печи восстановление MnО из жидкого шлака, вносящее основную долю марганца в чугун, протекает главным образом при температурах, начиная с 1200° С, т. е. в области нижней части распара, заплечиках и горне. Степень восстановления марганца составляет -~50%.
В связи со снижением необходимых содержаний марганца в чугунах для сталеплавильного производства при их выплавке в доменных печах нужны лишь минимальные добавки марганецсодержащих материалов. Кроме того, не требуется принятия специальных мер для возможно полного восстановления марганца шихты. Поэтому увеличивается производительность и снижается себестоимость продукта.
Обеспечение увеличения полноты восстановления марганца необходимо при плавке в доменной печи продуктов с повышенным его содержанием (зеркальный чугун и особенно ферромарганец). В этих случаях для максимального извлечения марганца из шихты и уменьшения его потерь необходимо иметь:
- повышенную основность шлака;
- снижение относительного количества шлака, что уменьшает абсолютные потери марганца;
- высокую температуру в нижних горизонтах печи.
Последнее достигается увеличением расхода кокса, максимальным нагревом дутья, и особенно эффективно, обогащением дутья кислородом. Так, выплавка ферромарганца на дутье, обогащенном кислородом до 30,7%, на Ново-Тульском металлургическом заводе позволила снизить расход кокса на 15—26% и повысить производительность в 1,5—2 раза по сравнению с работой на обычном дутье. Большую роль при этом играют уменьшение количества горнового газа, снижение температур отходящих газов и потерь тепла с ними.
Восстановление кремния
Значительные количества SiO2 содержатся в пустой породе руд, соединениях агломератов и в золе кокса. В составе агломератов кремний присутствует в виде силикатов железа, кальция и силикатов промежуточного состава (оливинов СаОx FeО(2-x) SiO2).
Двуокись кремния практически не восстанавливается газообразными восстановителями доменного газа СО и Н2, а может восстанавливаться только с участием углерода в области высоких температур. Выше 1500° С восстановление протекает с образованием значительных количеств легколетучего промежуточного окисла SiO, возгоны которого образуются при выплавке продуктов с повышенным содержанием кремния (ферросилиций и в меньшей степени литейные чугуны). При получении малокремнистых продуктов, в связи с более низкими температурами процесса, выделения SiO из зоны реакции практически не наблюдается.
Реакция восстановления SiO2 может быть записана следующим образом:
SiO2 + 2С = Si + 2СО — 611,27 кдж/моль (—146 ккал/моль).
Расчетная температура начала восстановления в стандартных условиях составляет 1540° С. Условия восстановления кремния из SiO2 значительно облегчаются при контактировании ее с железом. Восстанавливаемый кремний образует силициды железа, которые растворяются в железе и чугуне; в этом случае то же парциальное давление окиси углерода может достигаться при более низких температурах.
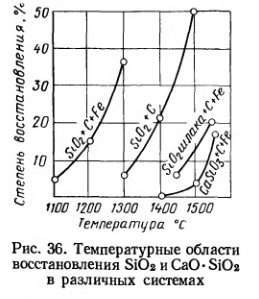
Лабораторными исследованиями было показано сильное возрастание степени восстановления SiO2 углеродом в присутствии металлического железа. Например, при 1300° С и выдержке в течение часа степень восстановления возрастала с 7 до 38 %.
Однако в доменном процессе силикаты железа и марганца переходят в расплав еще до восстановления этих элементов. Более тугоплавкий силикат кальция CaO-SiO2 восстанавливается значительно труднее, чем свободная двуокись кремния (рис. 36). Восстановление кремния из твердой SiO2 и твердых силикатов не получает значительного развития, так как еще до этого эти вещества переходят в расплав — образующийся в доменной печи шлак. При восстановлении кремния из шлака условия процесса меняются. Активность SiO2 снижается вследствие уменьшения ее концентрации и растворения в шлаке основных окислов (FeO, MnО и особенно СаО).Легко восстановимые окислы шлака FeO и MnО дополнительно препятствуют восстановлению SiO2, восстанавливаясь в первую очередь. По данным производственных исследований, содержание кремния в металле на уровне распара намного ниже, чем у фурм и в конечном чугуне: 0,04—0,06 % Si в распаре и 1,3—1,5 % в выпускаемом чугуне; при выплавке ферросилиция в распаре содержится 2,5 % Si, на горизонте фурм 11,6 % Si.
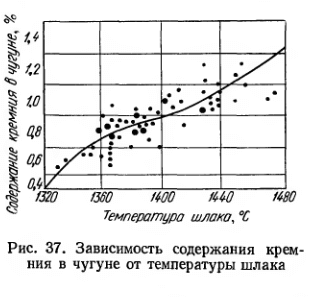
Содержание кремния находится в тесной связи с температурой в горне, являясь надежным показателем его теплового режима (рис. 37). Для выплавки чугунов с более высоким содержанием кремния желательны трудноплавкие шлаки, повышающие температуру горна. Трудноплавкость шлака достигается обычно при повышенном содержании Аl2O3 в шихте.
При выплавке высококремнистых чугунов и ферросплавов сильно возрастает расход топлива. Для его снижения прибегают к повышению температуры дутья и обогащению его кислородом. В последнем случае получается более богатый продукт (18 % Si вместо 12 % Si без O2).
Восстановление фосфора
Основным источником фосфора в шихте являются руды или агломераты (в среднем 0,05—0,06% Р). В некоторых рудах содержание фосфора может доходить до 1,5%, и выплавляемые высокофосфористые чугуны требуют особой технологии их передела в сталь. Главные соединения фосфора в рудах и агломератах: Fe2O3•7Н2O, ЗFеО•Р2О5 и ЗСаО•Р2О5.
Фосфаты железа способны более легко восстанавливаться в силу своей меньшей химической прочности и облегчения восстановления фосфора контактированием с восстанавливаемым железом. Восстановление осуществляется окисью углерода и частично углеродом при 900—1100° С с образованием фосфида железа Fe2Р, растворяющегося в железе по реакциям:
Преимущественно содержащееся в шихте соединение фосфора ЗСаO·Р2O5 является более химически прочным и интенсивно восстанавливается лишь при температурах с 1200° С с участием углерода:
ЗСаО·Р2О5 + 5С = ЗСаО + 2Р + 5СО — 1590 кдж/моль
Этот процесс также облегчается при контактировании с металлическим железом или чугуном, растворяющими фосфиды железа и фосфор. Ввиду позднего начала восстановления фосфора из фосфата кальция реакция не успевает закончиться до расплавления пустой породы и дальнейшее восстановление фосфора происходит из шлака. Несмотря на некоторое снижение активности фосфора в шлаке при повышении его основности фосфор практически полностью восстанавливается в чугун.
Таким образом, единственным средством получения чугуна с низким фосфором является подбор соответствующей шихты для доменного процесса.
Восстановление хрома, ванадия, никеля
При выплавке природнолегированных чугунов рудная часть шихты обычно содержит хром в виде хромита FeO (CaO, MgO) Сr2O3. Восстановление из него хрома происходит с участием углерода. В доменной печи хром полностью не восстанавливается в чугунки небольшая часть его теряется со шлаком. Степень восстановления составляет до 90%.
Окислы ванадия, присутствующие в некоторых фосфористых и титаномагнетитовых рудах, трудновосстановимы. Облегчающим условием является присутствие железа и повышенная основность шлака. Последняя увеличивает активность низших окислов ванадия в шлаке, имеющих слабоосновные свойства. Восстановление V2O3 и V2O2 происходит только при участии углерода, и при благоприятных условиях в чугун переходит 80% V шихты.
Закись никеля часто содержится в рудах вместе с соединениями хрома. Она восстанавливается гораздо легче FeO при небольших концентрациях СО в газе: NiO + СО = Ni + СO2. Температурный интервал протекания этой реакции в доменной печи 350— 900° С. В условиях доменной плавки извлечение никеля в чугун практически составляет 100%.
Марганец

Марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой. Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом.
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
Смотрите так же:
![]()
СТРУКТУРА

Марганец имеет 4 полиморфные модификации: α-Мn (кубическая объемноцентрированная решетка с 58 атомами в элементарной ячейке), β-Мn (кубическая объемноцентрированная с 20 атомами в ячейке), γ-Мn (тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая объемноцентрированная). Температура превращений: α=β 705 °С; β=γ 1090 °С и γ=δ 1133 °С; α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов.
СВОЙСТВА

Серебристо-белый цвет с легким серым налетом выделяет марганец. Он превосходит железо по твердости и хрупкости. Является парамагнетиком. При взаимодействии с воздушной средой происходит окисление марганца. Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца.
Плотность — 7200 кг/м 3 , t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.
При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород.
ЗАПАСЫ И ДОБЫЧА

Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 %.
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление).
ПРОИСХОЖДЕНИЕ

Вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
ПРИМЕНЕНИЕ

Марганец широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу.
Используются смеси хром — марганец, вольфрам-марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец. Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал характеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.
Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец. Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых кристаллов. Растворяется в водной среде, окрашивая её в фиолетовый цвет. Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета. При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием. Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.
Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, меди и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Марганец (англ. Manganese) – Mn
| Молекулярный вес | 54,93 г/моль |
| Происхождение названия | от немецкого Manganerz — марганцевая руда |
| IMA статус | отклонен |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/A.07-05 |
| Nickel-Strunz (10-ое издание) | 1.AE.30 |
| Dana (7-ое издание) | 1.1.39.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | стально-серый |
| Цвет черты | темно серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 6.5 |
| Плотность (измеренная) | 7,01 г/см 3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | парамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | 4 3m – гексатетраэдральная |
| Пространственная группа | I4 3m |
| Сингония | кубическая |
| Параметры ячейки | a = 6.287Å |
Марганец — важный металл с широким спектром применения


Серебристо-белый цвет с легким серым налетом выделяет марганец. Он превосходит железо по твердости и хрупкости. Является парамагнетиком. При взаимодействии с воздушной средой происходит окисление марганца. Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца. Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.
При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород.



Распространённость в природе
Ср. содержание М. в земной коре 0,1% по массе. В свободном виде в природе не встречается. Известно более 300 минералов М., из которых ок. 10 имеют пром. значение. В первичных породах М. входит в состав силикатов и гранитов (ср. содержание 0,06% по массе). Наиболее важны в пром-сти вторичные месторождения оксидов и карбонатов – минералы пиролюзит, псиломелан, манганит, браунит, гаусманит, родохрозит и др. (см. статьи Марганцевые породы, Марганцевые руды). При разрушении и выветривании первичных пород происходит вымывание дисперсных частиц оксидов М., железа, алюминия в моря, озёра и океаны, где они образуют железомарганцевые конкреции, являющиеся перспективным источником М. (содержат 15–30% М.). В биосфере М. энергично мигрирует в восстановит. условиях и малоподвижен в окислит. среде. М. наиболее подвижен в кислых водах тундры и лесных ландшафтов, где он находится в форме $ce$; культурные растения здесь часто страдают от избытка М. В сухих степях и пустынях в условиях щелочной окислительной среды М. малоподвижен и культурные растения нуждаются в марганцевых микроудобрениях.
Читайте также: Фрукты
ЗАПАСЫ И ДОБЫЧА

Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 %.
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление).




Историческая справка
Соединения М. были известны задолго до открытия этого элемента. В Древнем Египте самый распространённый минерал М. – пиролюзит применяли при произ-ве стекла и керамич. изделий. Долгое время пиролюзит называли чёрной магнезией и считали разновидностью магнитного железняка (магнетита). В 1774 К. Шееле показал, что пиролюзит – соединение неизвестного металла, а др. швед. химик Ю. Ган, нагревая минерал со смесью древесного угля и нефтяного масла, выделил металлич. М. Образец содержал большое количество примесей; высокочистый М. получен в 1930-х гг. электролизом растворов солей М. Назв. элемента происходит от лат. magnes – магнит или magnesia nigra – чёрная магнезия ($ce$).



ПРОИСХОЖДЕНИЕ

Вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Методы обогащения
Современные методы обогащения марганцевых руд основаны на разнице плотности, смачиваемости, магнитных характеристик разнообразных химических элементов. Благодаря ей удаётся произвести очистку руды от посторонних примесей.
Гравитационный
Гравитационные методы обогащения занимают ведущее место среди способов повышения концентрации полезного компонента в исходном материале – руде. Суть метода состоит в использовании неодинаковых физических характеристик. В данном случае – скоростей движения минеральных частиц в воздушной (пневматические процессы) или водной (гидравлические процессы) среде под воздействием гравитации или центробежных сил. Существуют специальные аппараты и технологии, позволяющие существенно увеличить содержание марганца в исходном сырье.
Гравитационно-магнитный
Добытая из месторождений руда из-за наличия в ней посторонних веществ непригодна к металлургическому переделу и требует обогащения. После обязательной промывки сырьё подвергается серии воздействий (гравитационных, магнитных, флотационных), последовательность и необходимость которых, определяется его размерами и химическим составом. Магнитная сепарация – это разделение материалов в неоднородном магнитном поле постоянного или переменного характера. Впервые изобретённая в конце XIX-го столетия, она стала основным методом обогащения железных и марганцевых руд. Так как, и те и другие обладают хорошими магнитными свойствами.
Флотация
Происходящий в жидкой среде под воздействием воздуха или с помощью добавления капель масла, процесс основан на смачиваемости жидкостью мелких частиц нужного вещества – марганца, и – несмачиваемости частиц посторонних примесей. На поверхности жидкости плавающая смесь воздуха, масла и минерала собирается, чтобы затем быть очищенной, высушенной и готовой для дальнейшего употребления в качестве концентрата.
Существуют и другие методы обогащения. В частности – рентгенометрическая сепарация. Впрочем, уровень современного состояния экономики позволяет разрабатывать индивидуальные технологии и оборудование, привязанное к конкретным залежам добываемого полезного ископаемого.
ПРИМЕНЕНИЕ

Марганец широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу. Используются смеси хром — марганец, вольфрам-марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец. Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %. В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал характеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.
Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец. Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых кристаллов. Растворяется в водной среде, окрашивая её в фиолетовый цвет. Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета. При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием. Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.
Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, меди и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани. Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Читайте также: Калорийность жареный нут. Химический состав и пищевая ценность.
Марганец (англ. Manganese) — Mn
| Молекулярный вес | 54,93 г/моль |
| Происхождение названия | от немецкого Manganerz — марганцевая руда |
| IMA статус | отклонен |





Биологическая роль
М. относится к микроэлементам: необходим для правильного развития клеток биологич. тканей, влияет на рост костей, образование гормонов щитовидной железы, функцию центр. нервной системы и половых желёз, репродуктивную функцию; является активатором ряда ферментов (аргиназы, холинэстеразы и др.), участвует в окислительно-восстановит. процессах фотосинтеза и др. биохимич. процессах. Содержание М. в растительных организмах – сотые, в животных организмах – тысячные доли процента. Дефицит М. у животных приводит к бесплодию и нарушению роста скелета, у растений – к замедлению роста и прекращению размножения. М. обнаружен во всех органах и тканях человека, но в осн. концентрируется в костной ткани, печени, почках, поджелудочной железе. Суточная потребность человека в М. составляет 2,0–5,0 мг и повышается при физич. нагрузках, недостатке солнечного света. Осн. количество М. поступает с пищей. Особенно много М. содержится в неочищенных злаках, зелёных листовых овощах, орехах.
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | стально-серый |
| Цвет черты | темно серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 6.5 |
| Плотность (измеренная) | 7,01 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | парамагнетик |
Незаменимый элемент
От древнего выдувания стекла до производства стали, от борьбы с кислородными радикалами до фотосинтеза, марганец всегда играл захватывающую роль в химии, геологии и биологии.
Марганец представляет собой типичный металл с атомным номером 25, расположенный в группе 7 периодической таблицы элементов Менделеева. Общепринятое обозначение — Mn. Конфигурация или электронная формула марганца [Ar] 3d5 4s2. Строение атома состоит из положительно заряженного ядра (+25) (с 25 протонами и 30 нейтронами), вокруг которого по четырём орбитам движутся 25 электронов. Присутствие пяти неспаренных электронов свидетельствует о том, что в его соединениях марганец может быть валентный от II до VII. Структурная (графическая) формула O = Mn = О показывает, как связаны атомы между собой внутри молекулы.

Способы получения
Существует три основных способа, которыми в промышленности получают марганец (химический элемент). Как читается на латыни название, мы уже обозначали — manganum. Если перевести его на русский, то это будет «да, действительно проясняю, обесцвечиваю». Таким своим названием марганец обязан проявляемым свойствам, известным с самой древности.
Однако, несмотря на известность, получить его в чистом виде для применения сумели лишь в 1919 году. Делается это следующими методами.
- Электролизный, выход продукта составляет 99,98%. Таким способом получают марганец в химической промышленности.
- Силикотермический, или восстановление при помощи кремния. При данном методе происходит сплавление кремния и оксида марганца (IV), в результате чего формируется чистый металл. Выход составляет около 68%, так как побочно идет соединение марганца с кремнием в силицид. Данный способ применяют в металлургической промышленности.
- Алюминотермический метод — восстановление при помощи алюминия. Также не дает слишком высокого выхода продукта, марганец образуется загрязненный примесями.
Производство данного металла имеет важное значение для многих процессов, осуществляемых в металлургии. Даже небольшая добавка марганца способна сильно повлиять на свойства сплавов. Доказано, что в нем растворяются многие металлы, заполняя собой его кристаллическую решетку.

По добыче и производству данного элемента Россия занимает первое место в мире. Также этот процесс осуществляется в таких странах, как:
Интересные факты

Интересных фактов связанных с марганцем достаточно много. Стоит начать с того, что есть подозрение того, что чрезмерное воздействие или потребление марганца напрямую связано с болезнью Паркинсона. Еще одним интересным моментом является то, что до Второй Мировой Войны американские банки производили долларовые монеты со стандартным содержанием 75% меди и 25% никеля. В 1942 году из-за нехватки металлического никеля его начали заменять более доступным серебром и марганцем. Процентное соотношение металлов в этих монетах было 56% меди, 35% серебра и на марганцевую составляющую приходились оставшиеся 9%. Таже самая учесть постигла и коллекционные монеты.
Еще одним интересным фактом является то, что марганец в связке с иттрием и индием образуют синий пигмент. Это открытие принадлежит профессору университета штата Орегон Мас Субраманяну. Интересным является тот факт, что в последний раз новое соединение пигмента синего цвета было обнаружено 200 лет тому назад.
Использование
Основная часть продукции, содержащей manganum, идет на нужды сталелитейной промышленности. Она потребляет ферромарганец для производства сталей и чугуна.
Читайте также: Правила приготовления имбирного чая + (ТОП 16 лучших рецептов)
Рекомендуем: ИРИДИЙ — подарок из космоса
Применение марганца обосновано в промышленностях:
- стекольной;
- фармацевтической;
- стекольной;
- электротехнической;
- лакокрасочной.
Mn(OH₂) применяют в текстильной промышленности, как коричневую краску.
В производстве олифы соединения металла применяют, как сиккатив.
Большое количество марганца идет в электротехническую промышленность, для производства сухих батарей.
Перманганат калия (в просторечии марганцовка) — антисептик. Применяется для полоскания горла, обработки ожогов, промывания ран. Как рвотное применяют внутрь.
Переработка марганцевых руд
Производство зависит от потребности разных сфер промышленности.
Способы получения металла:
- восстановлением пиролюзита кремнием, углеродом (редко — алюминием);
- электролизом раствора MnSO4; получаемый продукт осаждается на катоде;
- чистый металлический марганец получают электролитическим способом;
- в промышленных масштабах марганец часто получают в реакции восстановления углем из смеси марганцевых и железных руд.
История открытия
История открытия тянется со времен Античности. Плиний упоминал о «черной магнезии» (пиролюзите), но считал ее разновидностью магнитного железняка. То, что черная магнезия не притягивается магнитом, ученый объяснял просто. Античные ученые наделяли женскими и мужскими свойствами не только людей.

Электролитический марганец
При широте античных сексуальных предпочтений, Плиний объявил, что магнит «имеет мужскую природу, а женская природа черной магнезии его не вдохновляет».
Считается, что новый элемент обнаружил Шееле, работая с браунштейном (пиролюзитом). Новый металл называли браунштейном. Современное название металл марганец носит с XIX века.
Изотопы
Основная статья: Изотопы марганца
Марганец является моноизотопным элементом — в природе существует только один устойчивый изотоп 55Mn. Все другие изотопы марганца нестабильны и радиоактивны, они получены искусственно. Известны 25 радиоактивных изотопов марганца, имеющие массовое число А
в диапазоне от 44 до 70. Наиболее стабильными из них являются 53Mn (период полураспада
T
1/2 = 3,7 млн лет), 54Mn (
T
1/2 = 312,3 суток) и 52Mn (
T
1/2 = 5,591 суток). Преобладающей модой распада лёгких изотопов марганца (
А
< 55) является электронный захват (и иногда конкурирующий с ним позитронный распад) в соответствующие изотопы хрома. У тяжёлых изотопов (
А
> 55) основной модой распада является β−-распад в соответствующие изотопы железа. Известны также 7 изомеров (метастабильных возбуждённых состояний) с периодами полураспада более 100 нс.
Источник https://metallurgist.pro/vosstanovlenie-v-domennoj-pechi-okislov-margantsa-kremniya-fosfora-i-drugih-elementov/
Источник https://mineralpro.ru/minerals/manganese/
Источник https://kprfrd.su/svojstva-produktov/marganec-element.html