№11 Натрий
Натроном первоначально называли гидроксид натрия. В 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы — калий и натрий, назвав их потассий (Potassium) и содий (Sodium). Берцелиус, и затем Гесс в России предложили названия Natrium / Натрий, которое и закрепилось.
Нахождение в природе, получение:
В природе щелочные металлы в свободном виде не встречаются. Натрий входит в состав различных соединений. Наиболее важным является соединение натрия с хлором NaCl, которое образует залежи каменной соли (Донбасс, Соликамск, Соль-Илецк и др.). Хлорид натрия содержится также в морской воде и соляных источниках. Натрий относится к числу распространенных элементов. Содержание натрия в земной коре составляет 2,64%.
Получают электролизом расплавленного хлорида натрия или гидроксида натрия. Применяется также и восстановление его оксидов, хлоридов, карбонатов алюминием, кремнием, кальцием, магнием при нагревании в вакууме.
Физические свойства:
Натрий — серебристо-белый металл, его плотность — 0,97 г/см 3 , очень мягкий, легко режется ножом. Между атомами металлическая связь. Для вещества с такой связью характерны металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
Химические свойства:
Атом натрия при химическом взаимодействии легко отдает валентные электроны, переходя в положительно заряженный ион. На воздухе быстро окисляется, поэтому его хранят под слоем керосина.
При сгорании в избытке кислорода образует пероксид натрия, Na2O2
С водородом при нагревании образует гидрид Na + H2 = 2NaH
Легко взаимодействует со многим неметаллами — галогенами, серой, фосфором и др.
Бурно реагирует с водой: 2Na + 2H2O = 2NaOH + H2
Важнейшие соединения:
Оксид натрия , Na2O (бесцветный), реагирует с парами воды, углекислым газом, потому хранить лучше в безводном бензоле.
При непосредственной реакции натрия с кислородом получается смесь оксида и пероксида натрия. Для получения чистого оксида можно использовать реакцию: Na2O2 + 2Na = 2Na2O
Пероксид натрия , Na2O2 (желтый) кристаллическое вещество с ионной решеткой, взаимодействует с влажным углекислым газом воздуха, выделяя кислород: 2Na2O2 + 2CO2 = 2Na2CO3 + O2
Гидроксид натрия , NaOH — кристаллическое белое вещество, сравнительно легкоплавкое, термически очень устойчиво. При нагревании испаряется без потери воды. Хорошо растворяется в воде, в спиртах.
Галогениды натрия , бесцветные кристаллические вещества, хорошо растворимы в воде, за исключением NaF. Для них характерны восстановительные свойства.
Сульфид натрия , — Na2S. Бесцветное кристаллическое вещество с ионной решеткой. Хорошо растворимо в воде, является сильным восстановителем.
Соли , все соли хорошо растворимы, являются сильными электролитами.
Гидрид натрия , NaH — бесцветное кристаллическое вещество с кристаллической решеткой типа NaCl, анионом является H — . Получают пропусканием водорода над расплавленными металлом. Подвергается термической диссоциации не плавясь, легко разлагаются водой:
2NaH = 2Na + H2
NaH + H2O = NaOH + H2
Применение:
Соединения натрия — важнейшие компоненты химических производств. Используются в мыловарении, производстве стекла, средств бытовой химии.
Натрий важен для большинства форм жизни, включая человека. В живых организмах ионы натрия вместе с ионами калия выполняют функцию передатчиков нервного импульса. Также его ионы играют важную роль в поддержании водного режима организма.
Натрий в чистом виде получил в 1807 году Хемфри Дэви – английский химик, который незадолго до натрия открыл калий. Дэви проводил процесс электролиза одного из соединений натрия – гидроксида, расплавив который и получил натрий. Соединениями натрия человечество пользовалось со времён глубокой древности, содой природного происхождения пользовались ещё в Древнем Египте (calorizator). Называли элемент содий (sodium), иногда именно это название можно встретить даже сейчас. Привычное название натрий (от латинского natrium – сода) было предложено шведом Йенсом Берцелиусом.
Общая характеристика натрия
Натрий является элементом I группы III третьего периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 11 и атомную массу 22,99. Принятое обозначение – Na (от латинского natrium).

Нахождение в природе
Соединения натрия содержатся в земной коре, морской воде, в виде примеси, имеющей свойство окрашивать каменную соль в синий цвет из-за действия радиации.
Физические и химические свойства
Натрий является мягким пластичным щелочным металлом, имеет серебристо-белый цвет и блеск на свежем срезе (натрий вполне возможно разрезать ножом). При применении давления превращается в прозрачное вещество красного цвета, при обычной температуре кристаллизуется. При взаимодействии с воздухом быстро окисляется, поэтому хранить натрий необходимо под слоем керосина.

Суточная потребность в натрии
Натрий – важный для организма человека микроэлемент, суточная потребность в нём для взрослых составляет 550 мг, для детей и подростков – 500-1300 мг. В период беременности норма натрия в сутки составляет 500 мг, а в некоторых случаях (обильное потоотделение, обезвоживание, приём мочегонных препаратов) должна быть увеличена.
Продукты питания богатые натрием
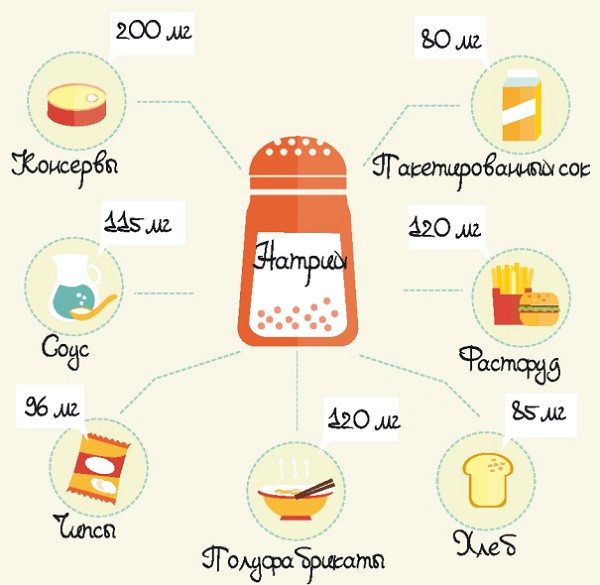
Натрий содержится практически во всех морепродуктах (раках, крабах, осьминогах, кальмарах, мидиях, морской капусте), рыбе (анчоусах, сардинах, камбале, корюшке и т.д.), куриных яйцах, крупах (гречневой, рисе, перловой, овсяной, пшённой), бобовых (горохе, фасоли), овощах (томатах, сельдерее, моркови, капусте, свёкле), молочных продуктах и мясных субпродуктах.

Полезные свойства натрия и его влияние на организм
Полезными для организма свойствами натрия являются:
- Нормализация водно-солевого обмена;
- Активизация ферментов слюнной и поджелудочной желез;
- Участие в выработке желудочного сока;
- Поддержание нормального кислотно-щелочного баланса;
- Генерирование функций нервной и мышечной системы;
- Сосудорасширяющее действие;
- Поддержание осмотической концентрации крови.
Усвояемость натрия
Натрий содержится практически во всех продуктах, хотя большую его часть (около 80%) организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонком кишечнике. Витамин D улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию.
Взаимодействие с другими
Повышенное потребление натрия вызывает накопление жидкости в организме, отеки, повышает кровяное давление. Большой прием натрия (соли) приведет к истощению запасов калия, кальция и магния.
Применение натрия в жизни
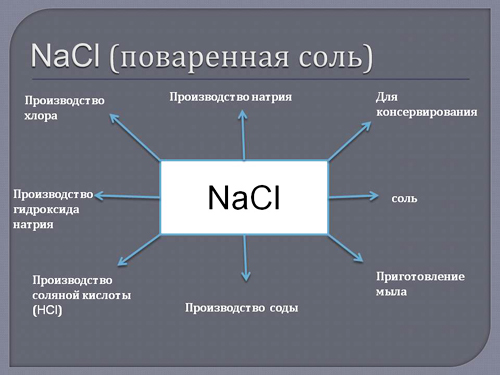
Применение металлического натрия – химическая и металлургическая промышленность, где он выступает в роли сильнейшего восстановителя. Хлоридом натрия (поваренной солью) пользуются все без исключения жители нашей планеты, это самое известное вкусовое средство и древнейший консервант.
Признаки нехватки натрия
Нехватка натрия обычно случается при чрезмерном потоотделении – в жарком климате или при физических нагрузках. Недостаток натрия в организме характеризуется ухудшением памяти и потерей аппетита, головокружением, быстрой утомляемостью, обезвоживанием, мышечной слабостью, а иногда – судорогами, кожными высыпаниями, желудочными спазмами, тошнотой, рвотой.
Признаки избытка натрия
Излишнее количество натрия в организме даёт о себе знать постоянной жаждой, отёками и аллергическими реакциями.
В 1807 г. английский химик Хемфри Дэви впервые получил металлический натрий путем электролиза гидроксида натрия. Электролиз — это разложение вещества на составные части при прохождении через его раствор электрического тока.
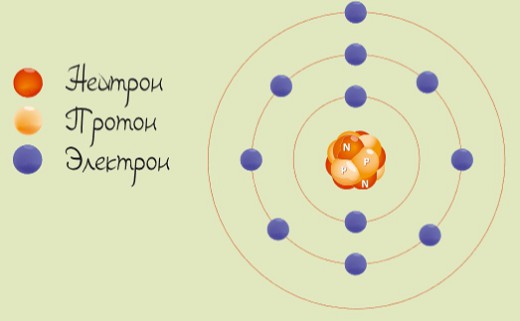
Натрий является щелочным металлом 1-й группы. У атома натрия 11 протонов и 11 электронов с одним валентным электроном на внешней оболочке.
Характеристики и свойства
Натрий представляет собой мягкий пластичный металл серебристо-белого цвета с блеском на срезе. Отличительной особенностью натрия является его быстрое окисление при взаимодействии с воздухом. Именно поэтому в химических лабораториях натрий хранят в стеклянных банках под слоем керосина и используют с учетом повышенных мер безопасности, а для проведения опытов используют минимальные количества этого металла.

Натрий — довольно легкий металл, который плавает на поверхности воды. Однако как только он вступает в контакт с водой, он пузырится, а затем и загорается ярко-желтым пламенем, а при взаимодействии натрия со льдом происходит взрыв.
Нахождение в природе
Натрий считается одним из самых распространенных химических элементов, однако из-за повышенной активности в чистом виде натрия в природе не существует. Чаще всего он встречается в соединении с хлором, а хлорид натрия — это не что иное, как поваренная соль, которая есть в доме каждого из нас. В природе хлорид натрия содержится в морской воде, соленых озерах и подземных месторождениях.

Где используется?
Для простого обывателя натрий — это, прежде всего, поваренная соль (NaCI) и пищевая сода (NaHCO3). Как используется поваренная соль, тебе объяснять не надо, а вот пищевая сода, или бикарбонат натрия, применяется в кулинарии как основной или дополнительный разрыхлитель теста во время выпечки, для производства различных газированных напитков и кондитерских изделий.
Широкое применение сплавы натрия с другими металлами находят в текстильной, стекольной, бумажной и прочих отраслях промышленности, в медицине и фотографии, атомной энергетике и металлургическом производстве. В химической промышленности натрий идет на производство удобрений. Использование солей натрия в строительной индустрии в качестве противоморозной добавки к бетону позволяет проводить работы при довольно низких температурах.
ВНИМАНИЕ! Натрий чрезвычайно опасен: он воспламеняется и взрывается даже при прикосновении к нему голыми руками из-за влажности кожи!
Важность натрия для человека
Натрий является одним из чрезвычайно важных элементов для человека, так как он содержится во всех органах, тканях и жидкостях. Натрий помогает поддерживать баланс жидкости в клетках. Поскольку этот элемент организмом не вырабатывается, а его запасы постоянно истощаются, мы должны получать его извне, с пищей. Натрий содержится практически во всех продуктах, тем не менее, большую его часть (почти 80%) наш организм получает из поваренной соли.

Морепродукты, гречневая, рисовая, овсяная и перловая крупы, молочные продукты, куриные яйца, бобовые, морковь, сельдерей, свекла, капуста и мясные субпродукты — основные источники натрия для нашего организма
Последствия недостатка
Признаки дефицита натрия в организме: обезвоживание, повышенная утомляемость, общая слабость, головокружение, рвота и тошнота. А избыток натрия проявляется в виде сильных отеков ног и лица, чувства жажды и повышения кровяного давления.

Серебристо-белый мягкий металл
Натрий/Natrium (Na), 11
0,93 (шкала Полинга)
(300 K) 142,0 Вт/(м·К)
На́трий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na (лат. Natrium ). Простое вещество натрий (CAS-номер: 7440-23-5) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
Натрий (а точнее, его соединения) использовался с давних времён. Например, сода (натрон), встречается в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом расплава гидроксида натрия.
Нахождение в природе
Кларк натрия в земной коре 25 кг/т. Содержание в морской воде в виде соединений — 10,5 г/л [5] . Металлический натрий встречается как примесь, окрашивающая каменную соль в синий цвет. Данную окраску соль приобретает под действием радиации.
Получение


Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью.
Первым промышленным способом получения натрия стала карботермическая реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля) [6] :

С появлением электроэнергетики стал более практичен другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия. В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить циркониетермическим методом, а также термическим разложением азида натрия.
Физические свойства




Натрий — серебристо-белый металл [9] , в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C), температура плавления 97,86 °C, температура кипения 883,15 °C.
Под давлением становится прозрачным и красным, как рубин [9] .
При комнатной температуре натрий образует кристаллы в кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм, Z = 2. При температуре -268°С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc, параметры ячейки a = 0,3767 нм, c = 0,6154 нм, Z = 2.
Химические свойства
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина.

При горении на воздухе или в кислороде образуется пероксид натрия:

С водой натрий реагирует очень бурно, реакция идёт с выделением водорода, который может самовоспламениться или взорваться, куски металла всплывают на поверхность и могут расплавиться:

Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, иода, углерода, благородных газов):
2NaCl >» width=»» height=»»/>
2NaH >» width=»» height=»»/>
Натрий более активный чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность нитриду лития):

С разбавленными кислотами взаимодействует как обычный металл:

С концентрированными окисляющими кислотами выделяются продукты восстановления:

Растворяется в жидком аммиаке, образуя синий раствор:

С газообразным аммиаком взаимодействует при нагревании

С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой.
Применение
Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель, в том числе в металлургии. Используется для осушения органических растворителей, например, эфира. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах грузовиков как теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12-24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна)
Хлорид натрия (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
Азид натрия (NaN3) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Изотопы натрия
В настоящее время (2012 г.) известно 20 изотопов с массовыми числами от 18 до 37 и 2 ядерных изомера натрия. Единственный стабильный изотоп 23 Na. У большинства изотопов период полураспада меньше одной минуты. Существуют также 2 радиоактивных изотопа с большим периодом полураспада. Это претерпевающий позитронный распад 22 Na с периодом полураспада 2,6027 года, его используют в качестве источника позитронов и в научных исследованиях. 24 Na, с периодом полураспада электронного типа 15 часов, используется в медицине для диагностики и для лечения некоторых форм лейкемии.
Биологическая роль
В высших организмах натрий находится большей частью в межклеточной жидкости клеток (примерно в 15 раз больше чем в цитоплазме клетки). Разность концентраций поддерживает встроенный в мембраны клетки натрий-калиевый насос, откачивающий ионы натрия из цитоплазмы в межклеточную жидкость.
Совместно с калием натрий выполняет следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1200 до 2300 миллиграммов в день. В виде поваренной соли это составляет от 3 до 6 граммов в день.
Натрий содержится практически во всех продуктах, хотя большую его часть организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако, чрезмерно солёная пища и пища богатая белками препятствуют нормальному всасыванию. Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированной пищей человека не встречается, однако, некоторые проблемы могут возникнуть при вегетарианских диетах и голодании. Временный дефицит может быть вызван использованием мочегонных препаратов, поносом, обильным потением или избыточным употреблением воды. Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте, и нарушение усвоения аминокислот и моносахаридов. Продолжительный дефицит вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, а также повышенное выделение калия с мочой. Максимальное количество соли, которое может быть переработано почками составляет примерно 20-30 граммов, большее количество уже опасно для жизни.
Меры предосторожности
В лабораториях небольшие количества натрия (примерно до 1 кг) хранят в закрытых стеклянных банках под слоем керосина, так, чтобы керосин покрывал весь металл. Банка с натрием должна храниться в металлическом несгораемом шкафу (сейфе). Натрий берут пинцетом или щипцами, отрезают скальпелем (натрий пластичен и легко режется ножом) на сухой поверхности (не на столе, а в стеклянной чашке) необходимое количество и остаток тут же возвращают в банку под слой керосина, а отрезанный кусок либо помещают в сухой керосин, либо тут же вводят в реакцию. Прежде чем приступить к работе с натрием, необходимо пройти инструктаж по технике безопасности, лица, впервые приступающие к работе с натрием, должны производить эту работу под наблюдением сотрудников, имеющих опыт такой работы. Обычно в лабораторных условиях для реакций используют количества натрия, не превышающие нескольких десятков грамм. Для демонстративных опытов, например, в школе на уроках химии стоит брать не более одного грамма натрия. После работы с металлическим натрием всю посуду и остатки натрия заливают неразбавленным спиртом и полученный раствор нейтрализуют слабым раствором кислоты. Следует обратить особое внимание, чтобы все остатки и обрезки натрия были полностью нейтрализованы до их выбрасывания, так как натрий в мусорном ведре может вызвать пожар, а в канализационном сливе может вызвать разрушение трубы. Хранить натрий дома и производить с ним какие-либо опыты не рекомендуется.
Воспламенение и даже взрыв металлического натрия при соприкосновении с водой и многими органическими соединениями может нанести серьёзные травмы и ожоги. Попытка взять кусочек металлического натрия голыми руками может привести к его воспламенению (иногда взрыву) из-за влажности кожи и образованию тяжелейших ожогов натрием и образующейся щелочью. Горение натрия создает аэрозоль оксида, пероксида и гидроксида натрия, обладающего разъедающим действием. Некоторые реакции натрия протекают очень бурно (например, с серой, бромом).
Этот химический элемент известен каждому. На бытовом уровне натрий – это родная поваренная соль. Без нее еда не еда.

Что представляет собой
Натрий – это элемент периодической системы Дмитрия Менделеева под № 11.
Мягкое серебристо-белое вещество, относится к металлам щелочной группы.
Структура кристаллической решетки вещества – куб.
Официальное обозначение вещества: Na, Natrium.
История
История взаимодействия человека с натрием исчисляется тысячелетиями:
- Натуральную соду использовали еще древние египтяне и иудеи: как мыло, консервант (при бальзамировании), отбеливатель, компонент красок, эмалей, пищевую приправу. На местных рынках продавали кусковую соду.
- Вещество упоминается Ветхим Заветом.
- Натрий как металл выделил в 1807 году Гемфри Дэви. Английский химик расплавил гидроксид вещества методом электролиза.
Формы нахождения в природе
В свободном виде вещество в природе не зафиксировано, только минералы либо соединения.
Тонна земной коры содержит в среднем 25 кг натрия, литр воды морей и океанов – 10,5 г соединений вещества.
Месторождения, добыча
Залежи натриевого сырья, особенно полевые шпаты, рассредоточены по планете.
Например, галит добывают Украина, Индия, США, Польша, ФРГ.
В России крупнейшие месторождения разрабатываются в Крыму, Красноярском и Пермском краях, Архангельской, Иркутской, Волгоградской, Астраханской областях, Оренбуржье.
Добыча ведется открытым либо шахтным способом.
Способы получения
Традиционный способ получения натрия – восстановление металла по способу Девиля. Карбонат натрия загружают в емкость с углем и нагревают до 1000°C.

Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Со времен промышленной революции основным стал электролиз. Исходное вещество – расплав хлорида натрия либо едкого натра.
Физико-химические характеристики
Металлический натрий, сохраняемый в минеральном масле
Физические характеристики вещества:
- Режется ножом. По этому признаку его легко отличить от прочих металлов.
- Хорошо проводит тепло и ток. Это достоинство оценили промышленники.
- Свежесрезанная поверхность металла блестит.
- Тонкие пластины отсвечивают фиолетом.
- Под давлением серебристо-белый металл становится прозрачно-красным.
Более интересны химические свойства.
Это очень активный металл:
- На воздухе мгновенно окисляется.
- Вступает в реакцию с большинством веществ.
Взаимодействие вещества с водой подобно шоу. Кусочек натрия всплывает, нагревает воду, плавится. Наконец становится белым шариком, который хаотично плавает по водной поверхности.
| Свойства атома | |
|---|---|
| Название, символ, номер | На́трий / Natrium (Na), 11 |
| Атомная масса (молярная масса) | 22,98976928 ± 2,0E−8 а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s1, 1s22s22p63s1 |
| Радиус атома | 190 пм |
| Химические свойства | |
| Ковалентный радиус | 154 пм |
| Радиус иона | 97 (+1e) пм |
| Электроотрицательность | 0,93 (шкала Полинга) |
| Электродный потенциал | -2,71 В |
| Степени окисления | −1 (в алкалидах); 0; +1 (наиболее частая) |
| Энергия ионизации (первый электрон) | 495,6(5,14) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,971 г/см³ |
| Температура плавления | 370,96 К; 97,81 °C |
| Температура кипения | 1156,1 К; 882,95 °C |
| Уд. теплота плавления | 2,64 кДж/моль |
| Уд. теплота испарения | 97,9 кДж/моль |
| Молярная теплоёмкость | 28,23 Дж/(K·моль) |
| Молярный объём | 23,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 4,2820 Å |
| Температура Дебая | 150 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 142,0 Вт/(м·К) |
| Номер CAS | 7440-23-5 |
Реакцию венчает фонтан водорода. Однако газ способен самопроизвольно загореться.
Присутствие натрия в образце обнаруживают по ярко-желтому цвету пламени.
Где используется
Человек использует натрий как чистый металл и соединения.
Промышленность
Главные потребители сырья – металлургия и химия. Здесь металл нашел применение как восстановитель.
Сферы использования, ассортимент продукции из металла:
- Качественный анализ органических веществ.
- Производство энергоемких аккумуляторов.
- Материал проводов, работающих под высоким напряжением.
- Теплоноситель для АЭС, других объектов (в сплаве с калием, цезием, рубидием).
- Основа ионных ракетных двигателей (в сплаве с калием и цезием).
- Наполнитель газоразрядных ламп для освещения больших пространств.
Металлурги с помощью соединений щелочного металла выделяют золото из руды, наносят золотое, серебряное гальванопокрытие. Обходчики – убирают растительность на железнодорожном полотне.
Другие сферы
Ученые задействуют изотопы натрия в исследованиях. С их помощью диагностируют и лечат лейкемию.
Вещество – один из первых консервантов и вкусовых приправ. Сегодня пищепром без него не обходится.
Речь о добавках:
- Глутамат натрия (Е621) – усилитель вкуса (особенно мясного).
- Бензоат (Е215) – консервант.
- Нитрит (Е250) – консервант.
- Цитрат (Е331) – эмульгатор, стабилизатор.
Плюс пищевая сода.
На рынке представлен ассортимент продукции из соединений натрия.
Цена определяется видом (руб./кг):
- Бихромат – 180-200.
- Сульфат – 17-25.
- Нитрит (технический) – 46-48.
Один из самых дорогих вольфрамосиликат – 7,4 тыс. руб. за кг.
Значение для человека
Натрий критично важен для жизнедеятельности человека.
Суточная потребность в микроэлементе для взрослых – до 510 мг, для детей до 18 лет – 500-900 мг, в зависимости от возраста.
Беременным требуется 500 мг. При физических, эмоциональных нагрузках, вызывающих обезвоживание, еще больше.
Чайная ложка содержит 2,3 г соли.
Питание
80% натрия человек получает из поваренной соли.
Другие источники вещества:
Металлом насыщены бобовые, куриные яйца, сельдерей, молочный ассортимент.
Биологические процессы
Натрий аккумулируется в межклеточной жидкости.
Задействован в следующих биологических процессах:
- Кислотно-щелочной баланс.
- Водно-солевой обмен.
- Выработка желудочного сока.
- Работа мышц, нервной системы.
- Регулирование кондиций крови.
В этом его почти всегда дополняет калий.
Симптомы дефицита/избытка вещества
О нехватке натрия организм сигнализирует повышенной потливостью.
Ее могут дополнять:
- Головокружение.
- Забывчивость.
- Утрата аппетита.
- Быстрая утомляемость.
- Судороги.
Возможны высыпания на коже, проблемы с ЖКТ (вздутие, тошнота, рвота, спазмы).
Избыток натрия проявляется отечностью, аллергией, неутолимой жаждой.
Предостережение
Опасен металлический натрий. На воздухе самопроизвольно воспламеняется. При контакте с водой, увлажненной поверхностью взрывается либо создает ожог.
Этими недостатками металла обусловлены условия хранения и правила работы.
Условия хранения вещества:
- Плотно закрываемая стеклянная тара.
- В ней вещество залито бензином, керосином, вазелиновым маслом.
- Тару держат в закрытом несгораемом коробе.
При работе с веществом соблюдается строгий алгоритм:
Остатки вещества нельзя выбрасывать в мусоропровод либо канализацию. В первом случае возникнет пожар, во втором – взрыв и разрушение водопровода.
Перед работой с натрием обязателен инструктаж по технике безопасности.
Это актуально для уроков химии в школе/вузе и любителей домашних химических опытов. Хотя домашние манипуляции с веществом не приветствуются.
Читайте также:
- Борьба со стихийными бедствиями кратко
- Состав необходимых для кадастрового учета документов кратко
- Раннеродовая община охотников собирателей и рыболовов кратко
- Средства индивидуальной бронезащиты кратко
- Внешние экономические связи перу кратко
Самый легкий металл. Какие существуют легкие металлы?
Первыми металлами, которые обнаружил человек, были золото, медь и серебро. Их применяли ещё в глубокой древности. Что представляют собой эти вещества? Какой металл самый легкий?
Металлы
Впервые человек обнаружил металлы, которые находятся близко к земной поверхности. Сначала это были медь, золото и серебро, позже к ним присоединились олово, железо, бронза и свинец. С развитием человечества список постепенно расширялся. В настоящее время открыто около 94 металлов.

Они представляют собой простые элементы, которые обладаю высокой электропроводностью и теплообменом, пластичностью, поддаются ковке, имеют характерный металлический блеск. В природе они часто встречаются в виде различных соединений и руд.
По своим качествам металлы разделяют на черные, цветные и драгоценные. Для использования их отделяют от руды, проводят чистку, легирование и другие виды обработки. Металлы являются частью живых организмов, присутствуют в морской воде.
В нашем теле они находятся в небольшом количестве, выполняя важные для жизни функции. В печени присутствует медь, кальций — в скелете и зубах, натрий – в цитоплазме клеток, железо является частью крови, а в мышцах находится магний.
Самый легкий металл
В сознании многих людей закрепилось мнение о металлах как о прочных, твердых и тяжелых веществах. Некоторые из них совершенно не подходят подданное описание. Существует ряд металлов, которые обладают небольшой прочностью и чрезвычайной для этих элементов легкостью. Они даже могут плавать на поверхности воды.
Самый легкий металл в мире – литий. При комнатной температуре его плотность является самой низкой. Она уступает воде практически в два раза и составляет 0,533 грамма на кубический сантиметр. Благодаря маленькой плотности он всплывает в воде и керосине.

Литий содержится в морской воде и верхней континентальной коре. В больших количествах самый легкий металл присутствует в звездном объекте Торна-Житкова, который состоит из сверхгиганта и красного гиганта.
При нормальных условиях литий представляет пластичный ковкий серебристый металл, настолько мягкий, что его можно разрезать ножом. Плавится при температуре 181 градус по Цельсию. Он токсичен и активно взаимодействует с окружающей средой, поэтому не используется в чистом виде.
Алюминий
После лития самый легкий металл – алюминий, к тому же он весьма прочный. Из-за активного применения в различных сферах он заслужил звание «металла XX века». В коре нашей планете он третий по распространенности элемент и первый среди металлов.
Алюминий имеет серебристо-белый цвет, обладает высокой пластичностью, тепло- и электропроводностью. Способен образовывать сплавы практически с любым металлом. Чаще всего используется вместе с магнием и медью. Многие его сплавы прочнее, чем сталь.
Алюминий слабо поддается коррозийным разрушениям благодаря образованию оксидных пленок. Он закипает при температуре 2500 градусов по Цельсию. Является слабым парамагнетиком. В природе металл содержится в виде соединений, его самородки встречаются исключительно редко в жерлах некоторых вулканов.
Легче легкого
Микролаттис – самый легкий металл, полученный искусственно. Он состоит из воздуха на 99,99 % и намного легче пенопласта. Металл создали ученые Калифорнийского университета, в 2016 году он был признан официально и был занесен в Книгу рекордов.

Секрет необычной легкости заключается в его структуре, напоминающую кости живых организмов. Металл представляет собой ячейки, которые сделаны из никелево-фосфорных трубок. Они пустые внутри, а их толщина в несколько раз уступает человеческому волосу.
Несмотря на легкость, микролаттис способен выдерживать большие нагрузки не хуже естественных металлов. Подобные свойства могут иметь широкое применение, одно из них — это создание искусственных легких.
Легкие металлы
В настоящее время такое понятие, как «легкие металлы», отсутствует в номенклатуре ИЮПАК. Таковыми принято называть металлы, имеющие небольшую плотность (как правило до 4,5 г/см 3 ) или вес. Стоит отметить, что в настоящее время существуют такие металлы, которые легко держатся на воде, а некоторые из них имеют вес, в разы меньший пенопласта, но при этом все равно остаются достаточно прочными.

Группа легких металлов, как правило, включает в себя следующие: алюминий, олово, магний, титан, бериллий и литий. Кроме этого, к данной группе металлов часто также добавляют галлий, индий, таллий, висмут и кадмий.
Наиболее важными металлами данной группы с точки зрения технического применения являются алюминий, магний, титан, бериллий. Именно данные металлы служат в качестве основы сплавов. Алюминиевые сплавы являются наиболее значимой и распространенной группой, однако, не смотря на это, для специфического применения также предлагаются и материалы из титана и бериллия.
Свойства легких металлов
Алюминий
Алюминий является металлом, идеально сочетающим в своих характеристиках легкость и прочность. Его первооткрывателем является датский физик Ганс Эрстед, который в 1825 году восстановил хлорид алюминия амальгамой калия при воздействии высоких температур, в результате чего и выделил данный металл.
Имеет характерный серебристо-белый окрас. Плотность металла составляет 2712 кг/м 3 . Плавится при температуре: 658 0 С (для технического алюминий) и 660 0 С (для алюминия высокой чистоты). Удельная теплота плавления алюминия – 390 кДж/кг. Закипает при температуре 2515,8 0 С. Имеет удельную теплоемкость 897Дж/кг*К. Обладает достаточно высокой пластичностью, которая составляет 35% у технического алюминия и 50% у чистого металла.
Первым изделием, для изготовления которого был применен алюминий, стала детская погремушка. Однако, с тех далеких времен, алюминий стал достаточно распространенным материалом. В настоящее время он нашел свое широкое применение во многих сферах человеческой деятельности. Однако, наибольший процент потребления данного металла приходится на упаковочную промышленность, особенно для банок с напитками.

Также следует отметить, что алюминий активно применяется наряду со сталью и в машиностроении. В настоящее время существует огромное множество алюминиевых сплавов, которые отвечают огромному количеству определенных и необходимых требований. Среди данных сплавов можно выделить две основные группы – литейные и деформируемые. Сплавы из каждой группы также можно разделить на те, которые способны дисперсионно твердеть и те, которые не способны. Чтобы материал сделать более прочным применяются:
- наклеп;
- легирование;
- дисперсионное твердение (старение).
Для того, чтобы получить оптимальные характеристики стареющих сплавов, их необходимо подвергнуть измельчению. В связи с этим, для дисперсионного старения деформируемых сплавов используется термообработка. Ее также могут применять с целью повышения прочности.
Среди наиболее важных литейных сплавов стоит выделить Al-Si, которые образуют эвтектическую систему с эвтектической точкой при 11,7% Si и 577 0 С. Сплавы, имеющие в своем составе содержание Si в пределах 11-13% называют близкими к эвтектическим. Кроме этого, они также известны как силуминовое литье. Стоит отметить, что если охлаждение сплава с содержанием Si 13% осуществляется медленно, то первично выделяющийся твердый раствор Si образует крупные, угловатые, игольчатые кристаллы, что, в свою очередь, чревато ярко выраженной хрупкостью подобных сплавов. Одним словом, такая структура является крайне неблагоприятной. Для того, чтобы подобного не происходило, применяют облагораживание металлов – т.е. добавляют в плавку 0,1% Na. При этом происходит очищение кристаллов кремния, а также их округление и, в конечном итоге, образование тонкодиспергированной эвтектики. Благодаря подмешиванию в сплав натрия происходит снижение эвтектической температуры до 564 0 С.
Если же сплав охлаждается за относительно короткий промежуток времени, что происходит в кокильном литье, то происходит действие, подобное облагораживанию металлов – сдвиг эвтектической точки при помощи переохлаждения. В результате происходит образование достаточно чистой эвтектической структуры, что избавляет от необходимости облагораживания металлов путем добавления в них натрия.
Деформируемые сплавы имеют в своем составе значительно меньшее количество легирующих элементов и примесей, в отличие от литейных сплавов. Деформируемые сплавы, обычно, отвечают более высоким требованиям. В связи с этим, для их выплавки применяется металлургический алюминий. К нестареющим деформированным сплавам относятся AlMg-сплавы. Они отличаются своей высокой твердостью и прочностью по причине легирования. Данные свойства сохраняются даже при отжиге и сварке.
К высокопрочным сплавам нового поколения относятся Al-Li- сплавы.
Титан
Представляет собой легкий тугоплавкий металл с характерным серебристо-белым цветом. Отличается своей высокой устойчивостью к коррозии. Данным свойством он обязан стабильному пассивированному оксидному слою, который образуется за достаточно короткий промежуток времени при слабых средствах окисления.

Для титановых сплавов характерна высокая жаропрочность, которая может достигать 1200 – 1400Н/мм 2 . Именно титановые сплавы занимают ячейку между алюминиевыми сплавами и жаропрочными сталями, поскольку могут применятся до температуры 500 0 С, а также до 1000 0 С при непродолжительном использовании.
Титановый сплав используется для изготовления деталей, которые подвергаются сильной нагрузке, с целью их облегчения. Например, шатуны для высокомощных двигателей изготавливаются именно из титановых сплавов. Это связано с тем, что данный материал обладает идеальным соотношением прочности на разрыв к плотности Rm/p.
Однако, для титановых сплавов характерна достаточно высокая стоимость, что препятствует их широкому применению, в отличие от Al-сплавов.
Титану, как и железу, присуще аллотропное превращение. Титан сохраняет свою гексагональную структуру до температуры 882 0 С.
Среди наиболее важных легирующих элементов, которыми обогащаются технические титановые сплавы, следует назвать ванадий, олово, молибден, цирконий, ниобий, а также хром и алюминий.
Самый легкий металл
Литий
Представляет собой легкий щелочной металл с характерным серебристо-белым окрасом, обладающий высокой мягкостью и пластичностью. Литий тверже натрия, однако по мягкости ему уступает свинец. Поддается обработке путем прессования и прокатки. В условиях комнатной температуры литий обладает кубической объемноцентрированной решеткой. Кристаллическая решетка относится к пространственной группе Р63/mmc.
Литий имеет самые высокие температуры плавления и кипения (180,54 0 С и 1340 0 С соответственно) из всех остальных щелочных металлов, а также самую низкую плотность в условиях комнатной температуры (0,533 г/см 3 , что является практически вдвое меньше, чем плотность воды). Благодаря своей низкой плотности литий может держаться не только на поверхности воды, но и плавать на поверхности керосина.

Литий имеет атом достаточно малых размеров, благодаря чему литий наделен особыми свойствами. Например, смешение лития и натрия возможно осуществить только лишь при температуре ниже 380 0 С. А вот с расплавленным калием, рубидием и цезием литий, в отличие от иных пар щелочных металлов, смешивающихся друг с другом в любых соотношениях, вообще невозможно смешать.
Первооткрывателем лития является шведский химик Иоганн Арфведсон, который в 1817 году выделил литий из минерала петалита.
Использование лития в чистом виде не возможно в связи с активным взаимодействием его с окружающей средой. Литий нашел свое широкое применение в медицине, пищевой, текстильной, силикатной промышленностях. Также его используют во время изготовления пиротехники, термоядерного оружия, оптики. Нередко литий может выступать в роли окислителя. Отдельные его сплавы также применяются в электронике и авиакосмической промышленности.
Кроме лития, также имеют свойство держаться на воде калий и натрий, остальные же металлы из группы легких являются тяжелее воды.
Металлургия легких металлов
Производство легких металлов, как и других, начинается с добычи руд или другого вида сырья. Добыча легких цветных металлов относится к цветной металлургии.
Для производства алюминия используется природное сырье – глинозем, который добывается из бокситов. Кроме этого, также для добычи алюминия могут быть использованы нефелины и алуниты. Производство алюминия имеет два основных этапа – производство глинозема и производство металлического алюминия.
Для производства титана используются титановые руды. На территории России они находятся на 19 месторождениях, семь из которых являются россыпными.
Руды легких металлов, особенно алюминия, в отличие от тяжелых, по содержанию полезного компонента сходны с железной рудой и являются транспортабельными. В связи с этим вполне рациональным является их перевозка на дальние расстояния.
Источник https://obrazovanie-gid.ru/pereskazy1/natrij-nahozhdenie-v-prirode-kratko.html
Источник https://fb.ru/article/285914/samyiy-legkiy-metall-kakie-suschestvuyut-legkie-metallyi
Источник http://mining-prom.ru/cvetmet/metallurgy/legkie-metally/




